


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、着火点:红磷与白磷 |
| B、密度:质量分数为20%的氨水与质量分数为20%的NaCl溶液 |
| C、氧化性:80%的硝酸与20%的硝酸 |
| D、熔点:二氧化硅和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2 |
| B、HCl |
| C、H2O(g) |
| D、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
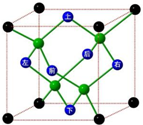 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com