
【题目】
步骤 | 实验过程 | 实验用品 |
I | 将干海带灼烧灰化 |
|
II | 将海带灰溶解、过滤 |
|
III | 氧化滤液中的I-,反应的离子方程式为 ② |
|
IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到 ③ ,说明海带中含有碘元素 |
|
(2)利用新制氨水、1mol/L NaBr溶液、淀粉液、以及II中所得溶液,验证卤素单质氧化性的相对强弱。
V分别取5mL 1mol/L NaBr溶液于两支小试管中
VI向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
VII向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
VIII……
④请写出步骤VI中反应的离子方程式 ;为验证溴的氧化性强于碘,步骤VIII的操作和现象是: ,溶液变为黄色。再加入 ,溶液变为蓝色。
⑤步骤VII的目的是 。
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下, ,得电子能力逐渐减弱,非金属性减弱。
【答案】(1)①玻璃棒;②2I-+H2O2+2H+=I2+2H2O;③下层溶液变为紫红色;
(2)④Cl2+2Br-===2Cl-+Br2;将VI所得黄色溶液滴入II所得滤液中;淀粉溶液;
⑤确认VI所得黄色溶液中无Cl2排除Cl2溴置换碘实验的干扰;
⑥原子核外电子层数依次增大,原子半径逐渐增大。
【解析】试题分析:(1)①海带灰溶解、过滤时使用烧杯、普通漏斗、玻璃棒、铁架台等,还缺少玻璃棒;②双氧水具有强氧化性,能够氧化滤液中的碘离子,反应的离子方程为:2I-+H2O2+2H+=I2+2H2O;③碘单质易溶于有机溶剂四氯化碳,且四氯化碳密度大于水,则混合液会分层,下层溶液变为紫红色;(2)④氯气氧化性大于溴单质,氯气将溴离子氧化成溴单质,反应的离子方程式为:Cl2+2Br-===2Cl-+Br2;将VI所得黄色溶液滴入II所得滤液中,溶液变黄色,然后滴入淀粉溶液,溶液变蓝,说明溴单质将碘离子氧化成了碘单质,证明溴的氧化性大于碘单质;⑤氯气能够氧化碘离子,所以通过步骤ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色,证明步骤VI中氯气不足,排除了氯气对溴置换碘实验的干扰,故答案为:确认VI所得黄色溶液中无Cl2排除Cl2溴置换碘实验的干扰;⑥根据元素周期律知识可知:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
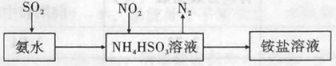
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
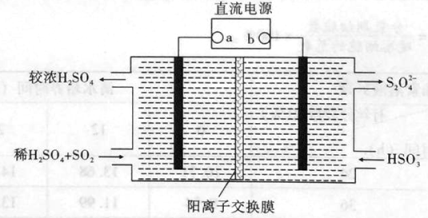
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源库,下列有关海水综合利用说法正确的是
A.海水的淡化,必须经过化学变化才能得到
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na
D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍。请回答下列问题:
(1)Y基态原子的价电子排布图为 ,其第一电离能在同周期元素中由大到小排第 位。
(2)W的元素名称为 ,其基态原子核外有 种空间运动状态不同的电子。
(3)R的中心原子采取的杂化方式为 ,写出R的一个等电子体: 。(填化学式)。
(4)Z与Y在一定条件下可形成高硬度的化合物,该化合物的晶体类型为 ,其由Z、Y构成的最小环为 元环。
(5)W的单质在900℃以下为α型体心立方晶胞,910℃以上W转变为γ型面心立方晶胞,晶胞结构分别如图所示。两种晶体中距离最近的铁原子间距离相同。则在800℃和1000℃下,铁的密度之比为 。
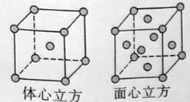
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因 .
2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
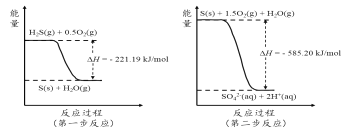
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________(“从A到B”或“从B到A”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子或分子是
A.NH、H+、NO、HCO
B.Na+、CH3COO-、CO、OH-
C.Na+、K+、SO、Cl2
D.K+、Al3+、SO、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
编号 | A | B | C | D |
强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com