
����Ŀ��ǰ������ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��һ��1��2���⻯������м��ЦҼ����Цм���������ԭ�ӹ�ƽ��;Z��L������2��δ�ɶԵ���;Gԭ��s�ܼ���P�ܼ����������;R������������ּ���������Ӳ�Ʒ�ĺ��IJ���;T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ���.
��1��Yԭ�Ӻ����______�ֲ�ͬ�˶�״̬�ĵ��ӣ�T+���Ӽ۵����Ų�ͼΪ________��
��2��TԪ�������ڱ���λ��Ϊ__________��
��3��G��Q��R����Ԫ�ص��Ȼ�����۵����±���G���Ȼ������Ը����������ֵ�ԭ����__________��Q���Ȼ������R���Ȼ����ͬѧ�����������Ϊ����ڵϷ��ӣ���д����ṹʽ____��
������ | G���Ȼ��� | Q���Ȼ��� | R���Ȼ��� |
�۵�/�� | 714 | 190 | -70 |
��4������Se����Zͬһ���壬Seԭ�ӱ�Zԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ_____�����������������ԭ�ӵ��ӻ���ʽΪ_____������2-5����Ԫ�ص��ʷֱ���H2��Ӧ����1mol��̬�⻯��ķ�Ӧ�����£���ʾ����1mol�����ⷴӦ�ȵ���_____������ĸ���ţ���
a.+99.7KJ/mol b.+29.7KJ/mol
c.-20.6KJ/mol d.-241.8KJ/mol
��5������Q��������ϵ���侧���߳�Ϊ405pm���ܶ���2.70g/cm3��ͨ������ȷ��Qԭ������ά�ռ��жѻ���ʽ________����֪NA=6.02��1023,4053=6.64��107���������о��������Qԭ�ӿɿ����ǽӴ��ģ���ʽ����Q��ԭ�Ӱ뾶=pm______����ֻ�г�����ʽ���ɣ�
���𰸡� 7 ![]() �������ڣ���IB�� MgCl2Ϊ���Ӿ��壬��AlCl3��SiCl4Ϊ���Ӿ���
�������ڣ���IB�� MgCl2Ϊ���Ӿ��壬��AlCl3��SiCl4Ϊ���Ӿ��� 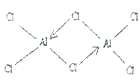 34 sp3 b �����������ܶѻ�
34 sp3 b �����������ܶѻ� ![]()
��������X��һ���⻯������м�����������������˵����������˫����μ���X��һ���⻯��Ϊ1��2��������ԭ�ӹ�ƽ�棬����XӦΪ̼Ԫ�أ�����1��2���⻯��Ϊ��ϩ��Z��L������2��δ�ɶԵ��ӣ�����������Ų�Ϊ1s22s22p2��1s22s22p4��X��Y��Zԭ������������������ZΪ��Ԫ�أ���YΪ��Ԫ�أ�Gԭ��s�ܼ���p�ܼ���������ȣ���Q�ĺ�������Ų�Ϊ1s22s22p4��1s22s22p63s2������G��ԭ��������Z��Z�ĵ����Ų�Ϊ1s22s22p4������Q�ĵ����Ų�Ϊ1s22s22p63s2����GΪþԪ����R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϣ���RΪ��Ԫ�أ�ԭ����������G��R֮���QΪ��Ԫ�أ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ�����ԭ������������36����TΪͭԪ�ء�
��1��YΪ��Ԫ�أ�ԭ������Ϊ7����ԭ�Ӻ����7�ֲ�ͬ�˶�״̬�ĵ��ӣ�T��ͭԪ�أ�ԭ������Ϊ29��ʧȥһ�����Ӻ���3d���ȫ������T+���Ӽ۵����Ų�ͼΪ![]() ����2��T��ͭԪ�أ�ԭ������Ϊ29�������ڱ���λ��Ϊ�������ڣ���IB�壻��3��G��Q��R����Ԫ�ص��Ȼ�����۵����±���G���Ȼ������Ը����������ֵ�ԭ����MgCl2Ϊ���Ӿ��壬��AlCl3��SiCl4Ϊ���Ӿ��壻�Ȼ����۵�����Ȼ��裬��������Ϊ����ڵϷ��ӣ���ṹʽΪ��
����2��T��ͭԪ�أ�ԭ������Ϊ29�������ڱ���λ��Ϊ�������ڣ���IB�壻��3��G��Q��R����Ԫ�ص��Ȼ�����۵����±���G���Ȼ������Ը����������ֵ�ԭ����MgCl2Ϊ���Ӿ��壬��AlCl3��SiCl4Ϊ���Ӿ��壻�Ȼ����۵�����Ȼ��裬��������Ϊ����ڵϷ��ӣ���ṹʽΪ�� ����4������Se����Oͬһ���壬Seԭ�ӱ�Oԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ8+8+18=34�������������H2SeO4����ԭ��Se�۲���Ӷ���=
����4������Se����Oͬһ���壬Seԭ�ӱ�Oԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ8+8+18=34�������������H2SeO4����ԭ��Se�۲���Ӷ���=![]() =4�����ӻ���ʽΪsp3�ӻ���ͬ����Ԫ�ش��϶��·ǽ��������������������ϵ��Ѷ�����ǿ��Se�ǵ�������Ԫ�أ��ʸ���2-5����Ԫ�ص��ʷֱ���H2��Ӧ����1mol��̬�⻯��ķ�Ӧ���У���ʾ����1mol�����ⷴӦ�ȵ���b����5��ÿ�������к�����ԭ�Ӹ���=
=4�����ӻ���ʽΪsp3�ӻ���ͬ����Ԫ�ش��϶��·ǽ��������������������ϵ��Ѷ�����ǿ��Se�ǵ�������Ԫ�أ��ʸ���2-5����Ԫ�ص��ʷֱ���H2��Ӧ����1mol��̬�⻯��ķ�Ӧ���У���ʾ����1mol�����ⷴӦ�ȵ���b����5��ÿ�������к�����ԭ�Ӹ���=![]() =
=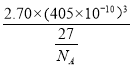 =4.00���þ�����ÿ�������Ϻ�ÿ�����϶�����һ��Alԭ�ӣ�Ϊ���������������ܶѻ����������������У�ÿ����ĶԽ���������ԭ�ӽ����ţ����ԶԽ��߳���=
=4.00���þ�����ÿ�������Ϻ�ÿ�����϶�����һ��Alԭ�ӣ�Ϊ���������������ܶѻ����������������У�ÿ����ĶԽ���������ԭ�ӽ����ţ����ԶԽ��߳���=![]() ��405pm���Խ���Ϊ�ĸ�Alԭ�Ӱ뾶֮�ͣ�����ÿ����ԭ�Ӱ뾶=
��405pm���Խ���Ϊ�ĸ�Alԭ�Ӱ뾶֮�ͣ�����ÿ����ԭ�Ӱ뾶=![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��15mLNO2���Թܵ�����ˮ�У���ַ�Ӧ��3NO2+H2O = 2HNO3 + NO�����Թ���ʣ����������Ϊ��ͬ��ͬѹ�²ⶨ���� ��
A. 0mL B. 2.5mL C. 5mL D. 7.5mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ�ˮ�������У�����ȷ����(����)
A. ��ˮ���������� B. ��ˮ��Һ���ɷ���ͬ
C. ��ˮ�й���6������ D. ��ˮ��һˮ�ϰ������ʵ���Ũ�����(��ˮ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У�ͬ����Ԫ��ԭ�Ӿ�����ͬ��
A. ���Ӳ��� B. �˵����
C. ��������� D. ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�в�����������ԭ��Ӧ���ǣ� ��
A.3CuS+8HNO3=3Cu��NO3��2+2NO��+3S��+4H2O
B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl
D.2KMnO4 ![]() ?K2MnO4+MnO2+O2��
?K2MnO4+MnO2+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ����Ҫ������������Ҫ����ˮ��ɰ�ǡ���֬��Ư����ɱ����������һ����ȡ�������ƵĹ������̣�

��֪����NaClO2���ܽ�������¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
��ClO2����ֻ�ܱ�����ϡ��״̬���Է�ֹ��ը�Էֽ⣬�����ֺϳ����á�
��ClO2���������Ժͼ�����Һ�в����ȶ����ڡ�
��1������Ĥ�������ö��Ե缫���һ��ʱ������NaClO3�������������ܷ�ӦʽΪ��____________________________________________�� �����������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2����Ca2����Ҫ������Լ��ֱ�Ϊ___________��___________��
��2����������������������___________��
��3���������ڷ�Ӧ�Ļ�ѧ����ʽΪ___________________________________���������ڵ��¶Ȳ��˹��ߵ�ԭ��Ϊ��_______________________________��
��4������Һ�еõ�NaClO23H2O�־����ʵ�����������____��__________�����ˡ�ϴ�ӡ����¸�����
��5�����������Ͽ�֪����pH��2.0ʱ��ClO2���ܱ�I����ȫ��ԭ��Cl�������ⶨ��Ʒ��NaClO2��MΪ90.5g/ mol���ĺ������ֽ������²�����
����� | ��ȡ��ƷWg����ƿ�У�������pH��2.0 |
����� | ����ƿ�м���������KI���壬������������ָʾ�� |
����� | ��c mol/L��Na2S2O3��Һ�ζ�������I����S4O62�� |
�ٲ�����з�����Ӧ�����ӷ���ʽ��_______________________________________��
���������ζ���������ȥ��VmL Na2S2O3��Һ������Ʒ��NaClO2����������Ϊ��__________������ĸ��ʾ�����û�������֪2Na2S2O3��I2=Na2S4O6��2NaI��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��Ӧ���ʵ���Ҫԭ���ǣ� ��
A. �μӷ�Ӧ������� B. �������
C. �¶Ⱥ�ѹǿ D. ����Ӧ����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ĵ���ƽ��������ͼ��ʾ��

��1������A���ʾ25��ʱˮ�ĵ���ƽ�������Ũ�ȣ����¶����ߵ�100��ʱ��ˮ�ĵ���ƽ��״̬�ƶ���B�㣬���ʱˮ�����ӻ���________�仯��_________��
��2����pH=8��Ba��OH��2��Һ��pH=5��ϡ�����ϣ�������100��ĺ��£���ʹ�����Һ��pH=7����Ba��OH��2������������Ϊ__________________��
����A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�������������ÿ������ֻ��һ���������һ����ظ����������� Na����Ba2����NH4+ ������ CH3COO����Cl����OH����SO42-����֪����A��C��Һ��pH������7��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��A��__________________��B�� __________________��
�������ӷ���ʽ��ʾA��Һ�ʼ��Ե�ԭ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ��������˵����ȷ���ǣ� ��

A. ��AΪAlCl3��Һ��B����Ϊ��ˮ����Ӧ�ٵ����ӷ���ʽΪ��A13++4NH3��H2O=AlO2+ 4NH4++2H2O
B. ��AΪFe��B����Ϊϡ���ᣬ��Ӧ�ڵ����ӷ���ʽΪ: 3Fe+8H++2NO3=3Fe2++2NO��+4H2O
C. ��AΪNaOH��Һ��B����ΪCO2������Ca(OH)2��Һ����C��D��Һ
D. ��AΪCl2��B����ΪNH3��ʵ���ҿ��ü��ȹ���C�ķ�����ȡNH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com