
【题目】氮化镓(GaN)是一种重要的半导体材料。某工厂利用铝土矿(成分为Al2O3、Ga2O3、Fe2O3等)为原料制备GaN的流程如下图所示:
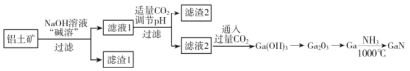
已知:镓与铝同主族,镓的熔点是29.8°C,沸点是2403°C;其氧化物和氢氧化物均为两性化合物;氢氧化物的电离常数如下:
两性氢氧化物 | Al( OH)3 | Ga( OH)3 |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
回答下列问题:
(1)为了提高 “碱溶”效率应采用的措施是__________(回答两种措施)。
(2)滤渣1的成分是_________。
(3)滤液2中通入过量CO2的理由是________(用离子方程式表示)。
(4)流程中利用镓与NH3在1000℃反应生成固体半导体材料 GaN,每生成l molGaN时放出15. 45 kJ热量,写出该反应的热化学方程式________。
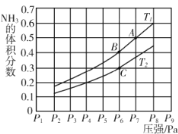
(5)在密闭容器中,充入一定量的Ga与NH3发生反应 ,测得反应平衡体系中NH3的体积分数与压强 P和温度T 的关系曲线如下图所示。图中A 点和C点化学平衡常数的大小关系: KA____KC (填“<”“=”或 “ > ”) , 判断的依据是________。
(6)已知铝土矿中Ga2O3的质量分数为 a%,某工厂使用 w 吨铝土矿经过一系列反应, 反应过程中镓元素的总利用率为 b%能制得________吨氮化镓
【答案】搅拌、适当提高温度、粉碎、适当提高溶液浓度等 Fe2O3 [Ga(OH)4]-+CO2= Ga(OH)3↓+![]() 或
或![]() + CO2+ 2H2O= Ga(OH)3↓+
+ CO2+ 2H2O= Ga(OH)3↓+![]() 2Ga(l) + 2NH3 ( g)
2Ga(l) + 2NH3 ( g) ![]() 2GaN(s) +3H2(g) △H = -30. 9kJmol-1 < 由 C 点 到 B 点 , NH3体积分数增大 ,说明 T1 > T2 ;反应放热 ,升高温度 , K 减小 ,所以 KA < KC
2GaN(s) +3H2(g) △H = -30. 9kJmol-1 < 由 C 点 到 B 点 , NH3体积分数增大 ,说明 T1 > T2 ;反应放热 ,升高温度 , K 减小 ,所以 KA < KC ![]()
【解析】
根据让固体加速溶解可采取的方法来解答;根据题中信息,Al2O3、Ga2O3均与NaOH反应,Fe2O3不与NaOH反应而进入滤渣中;根据AlO2-与过量的CO2反应的离子方程式类似写出GaO2-与CO2(过量)反应的离子方程式;由△H<0,根据图象判断T1、T2的高低和KA,KC的大小;由镓元素守恒,可计算生产GaN的质量,据此解答。
(1)为了提高碱溶效率可以将固体粉碎、搅拌、适当升高温度等,均能加速固体的溶解,也可适当提高NaOH溶液的浓度提高碱溶效率;答案为粉碎、搅拌、适当升高温度、适当提高溶液浓度等。
(2)根据铝土矿的成分为Al2O3、Ga2O3、Fe2O3等,由题中信息,镓与铝同主族,其氧化物和氢氧化物均为两性化合物,可知,加入NaOH溶液“碱溶”,Al2O3、Ga2O3均与NaOH反应进入溶液中,而Fe2O3不与NaOH反应,仍以固体形式存在,过滤时进入滤渣中,滤渣1的成分是Fe2O3;答案为Fe2O3。
(3)因为滤液2中主要是GaO2-离子,通入过量的CO2,CO2与GaO2-发生反应,生成Ga(OH)3沉淀,则离子方程式为GaO2-+CO2+2H2O=Ga(OH)3↓+HCO3-或[Ga(OH)4]-+CO2= Ga(OH)3↓+![]() ;答案为GaO2-+CO2+2H2O=Ga(OH)3↓+HCO3-或。[Ga(OH)4]-+CO2= Ga(OH)3↓+
;答案为GaO2-+CO2+2H2O=Ga(OH)3↓+HCO3-或。[Ga(OH)4]-+CO2= Ga(OH)3↓+![]()
(4)因为镓的熔点是29.8°C,沸点是2403°C,在1000℃时,镓为液体,与NH3反应生成固体GaN,则反应的化学方程式为Ga+2NH3![]() 2GaN+3H2,根据每生成l molGaN时放出15. 45 kJ热量,生成2molGaN时放出30.9kJ热量,热化学方程式为2Ga(l)+2NH3(g)
2GaN+3H2,根据每生成l molGaN时放出15. 45 kJ热量,生成2molGaN时放出30.9kJ热量,热化学方程式为2Ga(l)+2NH3(g)![]() 2GaN(s)+3H2(g)△H= -30.9kJ/mol;答案为2Ga(l)+2NH3(g)
2GaN(s)+3H2(g)△H= -30.9kJ/mol;答案为2Ga(l)+2NH3(g)![]() 2GaN(s)+3H2(g)△H= -30.9kJ/mol。
2GaN(s)+3H2(g)△H= -30.9kJ/mol。
(5)反应为放热反应,温度升高有利于逆反应,由C点到B点,氨气的体积分数增大,说明T1>T2,升温逆向移动,K减小,则KB<KC,而A点和B点是同温,KA=KB,故KA<KC;答案为<,△H<0,温度升高,平衡逆向移动,此时NH3的体积分数增大而K值减小;
(6)设制得x吨氮化镓,根据镓元素守恒,得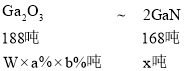 ,则x=
,则x=![]() =
=![]() (吨);答案为
(吨);答案为![]() 吨。
吨。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有丙炔和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体的体积为V(所有体积均在同温同压下测定)。
(1)若将上述5L气体在氧气中完全燃烧生成二氧化碳和水,消耗同温同压下氧气的体积V(O2)为___(取值范围)。
(2)若氢气的体积为1L,反应后的体积V=___L。
(3)若氢气在混合气体中的体积分数为x,试用x表示反应后的体积V=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置(资料:SO2能与酸性KMnO4反应:2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 )。
甲. 乙.
乙. 丙.
丙.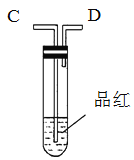 丁.
丁.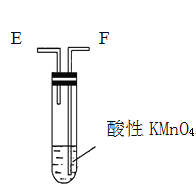
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接________,________接________,________接________;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2。乙中_______,丙中______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸乙酯用于食品防腐剂,工业上可用下列方法制备,以下说法错误的是
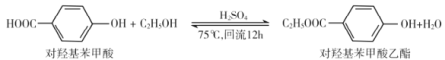
A.对羟基苯甲酸能发生缩聚反应、取代反应B.可用浓溴水检验产物中是否有对羟基苯甲酸乙酯生成
C.lmol对羟基苯甲酸乙酯最多与2molNaOH反应D.乙醇脱水生成的乙烯不存在顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“接触法制硫酸”的主要反应是2SO2+O2![]() 2SO3在催化剂表面的反应历程如下:
2SO3在催化剂表面的反应历程如下:
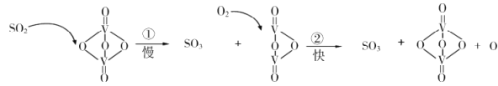
下列说法正确的是
A.使用催化剂只能加快正反应速率B.反应②的活化能比反应①大
C.该反应的催化剂是V2O4D.过程中既有V—O键的断裂,又有V—O键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。
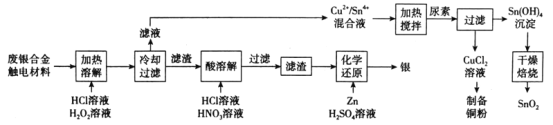
回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com