
【题目】常温下,用0.100 0 mol![]() L-1的NaOH溶液滴定20.00 mL未知浓度的某酸HX,滴定曲线如图所示。下列说法正确的是
L-1的NaOH溶液滴定20.00 mL未知浓度的某酸HX,滴定曲线如图所示。下列说法正确的是

A. 滴定过程可用甲基橙作指示剂
B. 常温下,HX的电离常数约为1×10-5
C. 点d溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
D. 点b溶液中:c(HX) + c(H+)=c(OH-) + c(X-)
【答案】B
【解析】
由滴定曲线可知,加入NaOH溶液20.00mL时,酸碱恰好中和,根据c(酸)×V(酸)=c(碱)×V(碱)可知,酸HA的物质的量浓度为0.100 molL-1;未滴定时溶液pH=3,可知酸HA为弱酸。
A.由图示可知,滴加20mLNaOH溶液恰好反应时生成NaX,溶液呈碱性,则应该选用酚酞作指示剂,故A错误;
B.a点pH=3,c(H+)=1×10-3mol/L,则该酸的电离平衡常数Ka=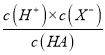 =
=![]() =1×10-5,故B正确;
=1×10-5,故B正确;
C.点d溶液中加入40mL等浓度的NaOH溶液,溶质为等浓度的NaX和NaOH,X-部分水解,则c(OH-)>c(X-),正确的离子浓度大小为:c(Na+)>c(OH-)>c(X-)>c(H+),故C错误;
D.点b溶液中加入10mL等浓度的NaOH溶液,溶质为等浓度的NaX和HA,此时溶液显酸性,即HX的电离大于X-的水解,溶液中c(Na+)>c(HX) ,另溶液中存在电荷守恒式c(Na+)+c(H+)=c(OH-)+c(X-),则c(HX)+c(H+)<c(OH-)+c(X-),故D错误;答案为B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】在高温下, Al与Fe2O3发生铝热反应后得到的固体混合物中主要含有Al2O3、Fe,还含有少量Fe2O3。从该样品中固体混合物分离出Al2O3,并回收Fe和Fe2O3的流程如下:

已知:NaAlO2 + CO2 + 2H2O = Al(OH)3↓ + NaHCO3
回答下列问题:
(1)固体①的成分是__________。溶液②的溶质是____________。
(2)加入过量NaOH溶液时,发生反应的离子方程式是__________。
(3)白色固体②与NaOH溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
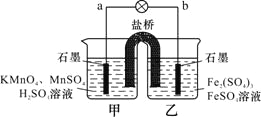
A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
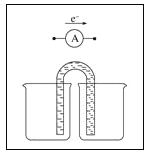
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。
(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
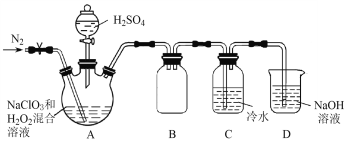
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_______________________________。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________________作指示剂,用0.100 0 mol![]() L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol
L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol![]() L-1。
L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
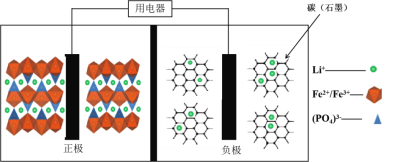
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com