
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
 | |||
 | |||
A.反应物A的百分含量 B.平衡混合气的平均摩尔质量
C.平衡混合气的密度 D.平衡混合气中物质B的百分含量
科目:高中化学 来源: 题型:
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是
| ||||||||||||||||||||||||||||||||||||
|
|
| ||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向沸水中滴加几滴FeCl3饱和溶液,继续加热 | 溶液呈红褐色 | 制备Fe(OH)3胶体 |
| B | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/L MgCl2 溶液,再滴加2滴0.1mol/L FeCl3溶液 | 先产生白色沉淀,又生成红褐色沉淀 | 在相同条件下,溶解度: Mg(OH)2<Fe(OH)3 |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | 不能证明H2S的酸性比H2SO4强 |
| D | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(酚酞作指示剂) | 溶液由红色褪为无色,且半分钟内不再变红色 | 可测定混合物中NaOH的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g) + 2B(s) yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压 ②增大A的浓度 ③增大C的量
④升温 ⑤降温 ⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广
泛。铁还有很多的化合物及其化学反应,如铁与水的反应:
3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g) △H
Fe3O4(s) + 4H2(g) △H
(1)已知:① 3Fe(s) + 2O2(g) Fe3O4(s) △H1=-1118.4 kJ/mol
Fe3O4(s) △H1=-1118.4 kJ/mol
② 2H2(g) + O2(g) 2H2O(g) △H2=-483.8 kJ/mol
2H2O(g) △H2=-483.8 kJ/mol
③ 2H2(g) + O2(g) 2H2O(l) △H3=-571.8 kJ/mol
2H2O(l) △H3=-571.8 kJ/mol
则△H =____________________(计算结果保留一位小数)。
(2)在t ℃时,该反应的平衡常数K=16,在2 L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,在t ℃时反应经过一段时间后达到平衡。
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为____________(结果保留一位小数)
②下列说法正确的是______________(填字母序号)
A. 若容器压强恒定,则反应达到平衡状态
B. 若容器内密度恒定,则反应达到平衡状态
C. 甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D. 增加Fe3O4就能提高H2O的转化率
(3)若将(3)中装置改为恒容绝热(不与外界交换能量)的装置,按下表
充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见下表:
|
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列:___________________(用A、B、C表示)。
(4)一种以甲醇做燃料的电池示意图如下图。写出该电池放电时负极的电极反应式:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:
|

(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 ▲ 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ▲ 。(填写编号)
a.减少压强 b.升高温度
c.不断补充空气 d.及时分离出SO3
(3)在生产中,为提高催化剂效率采取的措施有 ▲ , ▲ (答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 ▲ 。(填写编号)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
反应达若平衡后测得平衡常数为K,此时O2的转化率为x,则K和x的关系满足K= ▲ 。
(5)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 ▲ 。
② 图2中时刻t2发生改变的条件是 ▲ 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
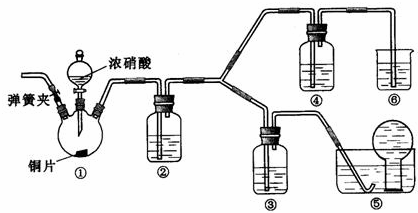
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应

(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前先检验装置的气密性,再加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了4个试验来判断两种看法是否正确。这些方案中可行的是 (选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 向该绿色溶液中通入氮气,观察颜色变化
c. 加水稀释绿色溶液,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的离子方程式不正确的是 ( )。
A.氨水使酚酞溶液变红:NH4++H2ONH3·H2O+H+
B.醋酸使碳酸钙溶解:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com