
下列解释事实的离子方程式不正确的是 ( )。
A.氨水使酚酞溶液变红:NH4++H2ONH3·H2O+H+
B.醋酸使碳酸钙溶解:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
 | |||
 | |||
A.反应物A的百分含量 B.平衡混合气的平均摩尔质量
C.平衡混合气的密度 D.平衡混合气中物质B的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是
( )。
 A.3 mol NF3与水完全反应生成HNO3和NO,转移
A.3 mol NF3与水完全反应生成HNO3和NO,转移
电子数2 NA
B.标准状况下,32 g硫(结构见图)含SS的数目为2 NA
C.标准状况下11.2 L正戊烷所含共用电子对数为8NA
D.含a mol·L-1 H+的醋酸溶液稀释10倍后,H+为0.1aNA
查看答案和解析>>
科目:高中化学 来源: 题型:
在下述条件下,一定能大量共存的离子组是 ( )。
A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式书写正确的是( )。
A.稀硝酸和过量铁屑反应:Fe+4H+ +NO3-===Fe3++NO↑+2H2O
+NO3-===Fe3++NO↑+2H2O
B.向硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4 ++OH-===NH3↑+H2O
++OH-===NH3↑+H2O
C.氯化铝溶液中加入过量氨水:A l3++4NH3·H2O===AlO2-+4NH4++2H2O
l3++4NH3·H2O===AlO2-+4NH4++2H2O
D.H2C2O4使酸性KMnO4溶液褪色:5H2C2O4+6H++2MnO4-===10CO2↑+
2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:

冶炼中的主要反应:Cu2S+O2 2Cu+SO2
2Cu+SO2
(1)烟气中的主要废气是________,从提高资源利用率和减排考虑,其综合利用方式是_________________________________________________________。
(2)电解法精炼铜时,阳极是________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽________(填“阳极”或“阴极”)的槽底,阴极的电极反应式是_______________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(Ksp)
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 mol3·L-3 | 4.0×10-38 mol4·L-4 | 3.0×10-17 mol3·L-3 | 2.2×10-20 mol3·L-3 |
①调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是________。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是_________________________________________________________________。
加入H2O2后发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
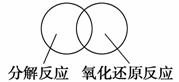
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
 |
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42-===BaSO4↓”来表示,请写出有关反 应的化学方程式(3个):
应的化学方程式(3个):
①_________________________________________ _____________________;
_____________________;
②______________________________________________________________;
③_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从能量的变化和反应的快慢等角度研究反应: 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 提高氧气的浓度
C. 提高反应的温度 D. 降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。

(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
| 化学键 | H—H | O=O | H—O |
| 键能 | 436 | 496 | 463 |
由此计算2molH2在氧气中燃烧生成气态水放出的热量
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com