
【题目】如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。

请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________;制出的氨气应使用________________法来收集,要得到干燥的氨气可选用____________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是__________和____________。
(3)学生丙用图C所示装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____________________。
(4)学生丁将装置C误装为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法:___________________。
(5)学生戊用装置E(盛有水)吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入E装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式:______________________。
【答案】 2NH4Cl+Ca(OH)2 ═CaCl2+2NH3↑+2H2O 向下排空气 碱石灰(或氢氧化钠固体、氧化钙固体等) 氧化钙(或氢氧化钠固体) 浓氨水 打开止水夹,挤出胶头滴管中的水 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,赶出玻璃导管中的空气,氨气与水接触,即发生喷泉 4NH3+5O2![]() 4NO+6H2O 2NO+O2===2NO2
4NO+6H2O 2NO+O2===2NO2
【解析】(1)学生甲用图A所示装置制备氨气,图A装置的特点是固体加热制取气体,结合实验室制氨气的原理,该法制取氨气的原理为氯化铵和氢氧化钙在加热条件下反应,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;由于氨气密度比空气小、易溶于水,所以不能采用排水法收集,只能用向下排空气法的收集;反应过程中产生水,氨气中混有水蒸气,可用碱石灰吸收水蒸气,但不能用氯化钙,因为它与氨气反应生成CaCl28NH3,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;由于氨气密度比空气小、易溶于水,所以不能采用排水法收集,只能用向下排空气法的收集;反应过程中产生水,氨气中混有水蒸气,可用碱石灰吸收水蒸气,但不能用氯化钙,因为它与氨气反应生成CaCl28NH3,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;向下排空气法;碱石灰;(2)反应B装置特点是不需要加热,向CaO中滴加浓氨水,CaO+H2O=Ca(OH)2,反应放热,NH3H2O
CaCl2+2NH3↑+2H2O;向下排空气法;碱石灰;(2)反应B装置特点是不需要加热,向CaO中滴加浓氨水,CaO+H2O=Ca(OH)2,反应放热,NH3H2O![]() NH3↑+H2O,使浓氨水中的氨气逸出,氢氧化钠溶于水放热,使浓氨水中的氨气逸出,故答案为:氧化钙或氢氧化钠;浓氨水;(3)NH3极易溶解于水,通常状况下,1体积水溶解700体积氨气,打开止水夹挤出胶头滴管中的水,由于氨气迅速溶解在挤出胶头滴管中的水,导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,故答案为:打开止水夹,挤出胶头滴管中的水;(4)装置D没有胶头滴管,打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,气体从烧瓶中逸出,赶出玻璃导管中的空气,氨气极易溶于水,氨气与水接触,烧瓶内压强减小,即发生喷泉,故答案为:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,赶出玻璃导管中的空气,氨气与水接触,即发生喷泉;(5)将经加热的铂丝插入戊装置的锥形瓶内,发生氨的催化氧化反应4NH3+5O2
NH3↑+H2O,使浓氨水中的氨气逸出,氢氧化钠溶于水放热,使浓氨水中的氨气逸出,故答案为:氧化钙或氢氧化钠;浓氨水;(3)NH3极易溶解于水,通常状况下,1体积水溶解700体积氨气,打开止水夹挤出胶头滴管中的水,由于氨气迅速溶解在挤出胶头滴管中的水,导致烧瓶内气体压强迅速减小,导致溶液进入烧瓶产生喷泉现象,故答案为:打开止水夹,挤出胶头滴管中的水;(4)装置D没有胶头滴管,打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,气体从烧瓶中逸出,赶出玻璃导管中的空气,氨气极易溶于水,氨气与水接触,烧瓶内压强减小,即发生喷泉,故答案为:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,赶出玻璃导管中的空气,氨气与水接触,即发生喷泉;(5)将经加热的铂丝插入戊装置的锥形瓶内,发生氨的催化氧化反应4NH3+5O2![]() 4NO+6H2O,产物为无色的一氧化氮和水,产生的一氧化氮能和氧气反应生成红棕色的NO2,2NO+O2═2NO2,NO2为红棕色气体,故答案为:4NH3+5O2
4NO+6H2O,产物为无色的一氧化氮和水,产生的一氧化氮能和氧气反应生成红棕色的NO2,2NO+O2═2NO2,NO2为红棕色气体,故答案为:4NH3+5O2![]() 4NO+6H2O,2NO+O2═2NO2。
4NO+6H2O,2NO+O2═2NO2。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。

(1)写出B的化学式:______________C的化学式:____________________。
(2)写出D与I溶液发生反应的离子方程式:_________________。
(3)写出L→M的现象是:________________________。
(4)从G与J反应后的混合物中得到M的操作方法叫做___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质.下列不属于抗氧化物质的是( )
A.生石灰
B.亚硫酸钠(Na2SO3)
C.铁粉
D.硫酸亚铁(FeSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 过滤时,玻璃棒与三层滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,W(g)体积分数增加,则正反应是放热反应
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.平衡正向移动,化学平衡常数一定增大
D.该反应可表示为X(g) + 2Y(g)![]() 2Z(g) + 2W(g)
2Z(g) + 2W(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
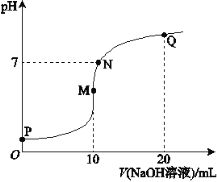
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生活的认识正确的是( )
A. 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B. 新鲜蔬菜做熟后,所含维生素C不会有损失
C. 常温下铝遇浓硝酸钝化,可用铝罐车运输浓硝酸
D. “天宫一号”使用的碳纤维,是一种新型有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com