
【题目】已知氮元素可以形成多种化合物。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是__________________________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有______mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在______(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是__________(填标号)。
a.CF4 b.CH4 c.NH![]() d.H2O
d.H2O

【答案】 N>O>C 3 d c
【解析】本题考查原子结构与性质,涉及核外电子排布、电离能的大小比较,杂化轨道、配位键等知识,综合考查学生的分析能力和基本概念的综合运用能力,为高考常见题型与高频考点,注意相关基础知识的学习。
(1)根据同周期元素从做左到右第一电离能增强,但第ⅤA族的元素原子为半满结构,第一电离能大于第ⅥA族元素,即第一电离能顺序为:N>O>C。(2) 若N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)中有4mol氮氢键断裂,说明有1mol肼参加反应,有1.5mol氮气生成,每个氮气分子中含有两个π键,所以形成的π键有3mol。(3) N2H6SO4晶体类型与硫酸铵相同,都为离子晶体,N2H62+和SO42-之间存在离子键,N2H62+中氮和氢之间形成6个共价键(其中2个配位键),氮和氮之间形成共价键,硫酸根离子中硫和氧之间形成共价键,不含范德华力,故选d。(4)注意氢键的形成条件以及成键元素,本题中嵌入某微粒分别与4个氮原子形成4个氢键,由成键元素及数目可知为铵根离子。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化钙(CaC2)是重要的基本化工原料,工业上主要用于生产乙炔,进而用于生产其他有机物。以碳化钙为原料生产聚1,3-丁二烯(![]() )的合成路线如下图所示。回答下列问题:
)的合成路线如下图所示。回答下列问题:

(l)写出碳化钙生成乙炔的化学方程式:______________。
(2)A的结构简式为______________;①和②的反应类型分别为_______、_______。
(3)若聚1,3-丁二烯的平均相对分子质量为27000,则n=______________。
(4)三分子乙炔在一定条件下可聚合成环状分子,该分子的结构简式可表示为______________。
(5)以丙炔和溴苯为原料(无机试剂任选),设计制备正丙苯的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组电极材料和电解质溶液中,不能组成原电池的是( )
A.铜片、石墨棒、稀硫酸
B.铜片、石墨棒、硝酸银溶液
C.锌片、铜片、稀盐酸
D.铜片、铁片、氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
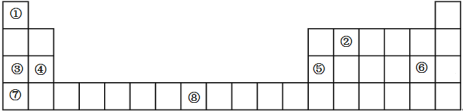
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________。
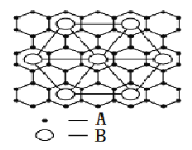
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________。
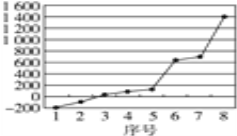
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______(填元素符号);其中电负性最大的是______(填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
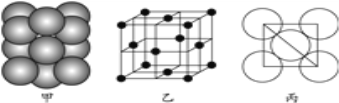
若已知⑤号元素原子半径为d cm,NA代表阿伏加德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
A. 增大 B. 不变 C. 变小 D. 因条件不足无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液:A13+、NH4+、Cl-、S2-
B. 在含0.1 mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
C. ![]() =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 在含0. 1mol/LFeCl3溶液中:K+、NH4+、I-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com