
【题目】下列电子转移方向和数目的判断正确的是
A.  B.
B. 
C.  D.
D. 
【答案】B
【解析】分析: 本题考查氧化还原反应中电子的转移以及元素化合价的改变,元素化合价升高失电子被氧化,化合价降低得电子被还原,以此分析各选项。
A项,二氧化锰中的锰元素应该为得到电子而化合价降低,盐酸中的氯元素失去电子,化合价升高,故A项错误;
B项,0价的硫元素变成+4价要失去4个电子,变成-2价要得到2个电子,且作还原剂的硫与作氧化剂的硫物质的量之比为1:2,故B项正确;
C项,该反应中氯酸钾中的氯元素得到5个电子变为氯气中0价的氯原子,5分子的盐酸中的氯原子失去5个电子变为氯气中0加的氯原子,转移的电子数应该为5,该项中转移电子数和转移方向都错了,故C项错误;
D项,氯酸钾中氯元素得到电子化合价降低变为氯化钾中的氯,氯酸钾中的氧元素失去电子化合价升高变为氧气,因此图示的电子转移方向错误,故D项错误。
综上所述,本题正确答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氮元素可以形成多种化合物。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是__________________________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有______mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在______(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是__________(填标号)。
a.CF4 b.CH4 c.NH![]() d.H2O
d.H2O

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是( )
A.元素原子的核外电子排布呈周期性变化B.元素的相对原子质量逐渐增大
C.元素的原子半径呈现周期性变化D.元素化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHCO3和Na2CO3是常见的钠盐,下列对它们的俗名、分类和用途描述不正确的是( )
A.NaHCO3可做治疗胃酸过多的药剂B.Na2CO3俗名纯碱,属于碱
C.Na2CO3可用于清洗餐具上的油污D.NaHCO3可用于泡沫灭火器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。制备K2FeO4如下图:查阅资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
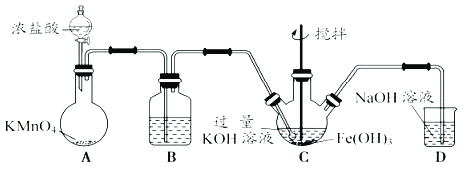
(1)A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为______,A中化学反应的还原剂是______。
(2)装置B的作用是除杂,所用试剂为___________。
(3)C为制备K2FeO4装置,KOH溶液过量的原因是_________________________。
(4)D为尾气处理装置,发生反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氟酸(又名氟氧酸)是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O═HOF+HF。该反应中水的作用与下列反应中水的作用相同的是
A. 氟单质与水反应制氧气 B. 钠与水反应制氢气
C. 氯气与水反应制次氯酸 D. 过氧化钠与水反应制氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )
A.乳浊液B.溶液C.胶体D.悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com