
【题目】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
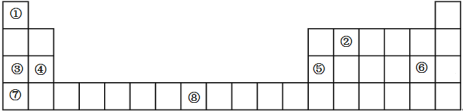
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________。
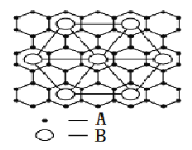
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________。
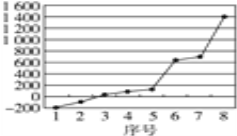
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______(填元素符号);其中电负性最大的是______(填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
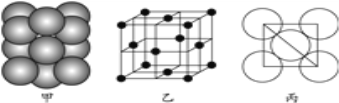
若已知⑤号元素原子半径为d cm,NA代表阿伏加德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。
【答案】 略 8 Si 2 ![]()
【解析】本题考查物质结构与性质,涉及核外电子排布、晶胞结构与计算、元素周期律、晶体类型与单质熔沸点的关系等知识点,晶胞计算中关键问题是确定晶胞的棱长。
根据元素周期表的结构分析,①为氢,②为碳,③为钠,④为镁,⑤为铝,⑥为氯,⑦为钾,⑧为铁。(1)铁元素的基态原子价电子排布图为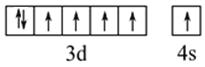 。(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个钾为6个小三角形共用,占有的钾原子数为
。(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个钾为6个小三角形共用,占有的钾原子数为![]() ,故碳原子数和钾原子数之比是4:
,故碳原子数和钾原子数之比是4:![]() =8,故x=8。(3)第三周期8种元素中的单质中只有硅为原子晶体,熔沸点最大,由图可知序号“8”代表的为硅,同周期随原子序数增大,电负性增大,故氯元素电负性最大,氯气的沸点仅高于氩,故序号为“2”的为氯。(4)由晶胞结构可知,晶胞中铝原子的数目为
=8,故x=8。(3)第三周期8种元素中的单质中只有硅为原子晶体,熔沸点最大,由图可知序号“8”代表的为硅,同周期随原子序数增大,电负性增大,故氯元素电负性最大,氯气的沸点仅高于氩,故序号为“2”的为氯。(4)由晶胞结构可知,晶胞中铝原子的数目为![]() ,该晶胞中原子的质量是
,该晶胞中原子的质量是![]() ,由信息可知晶胞图可知为面心立方,铝原子半径为dcm,由图丙可知,晶胞的棱长为
,由信息可知晶胞图可知为面心立方,铝原子半径为dcm,由图丙可知,晶胞的棱长为![]() ,故晶胞的体积为
,故晶胞的体积为![]() ,所以其密度为
,所以其密度为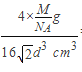 =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:______________________,其中含有的化学键是________________。
(2)用电子式表示Y2O的形成过程:_______________________________________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是__________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是_________(填化学式)。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物的化学式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的分子式为C7H8O,水溶液呈弱酸性,将适量溴水加入A的溶液中,立即产生白色沉淀,A苯环上的一溴代物有两种结构。回答下列问题:
(l)有机物A的结构简式为__________。
(2)有机物A的酸性__________(填“大于”或“小于”)碳酸。
(3)写出A与NaOH溶液反应的化学方程式:____________________。
(4)芳香族化合物B是A的同分异构体,B能与Na反应但不能与NaOH溶液反应。
①B的结构简式为__________。
②写出有机物A与B在浓硫酸作用下,生成醚的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2 +11O2![]() 4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是
4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是

A. VB2电极发生的电极反应为: 2VB2+11H2O – 22e![]() V2O5+2B2O3+22H+
V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为200mL,则CuSO4溶液的浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氮元素可以形成多种化合物。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是__________________________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有______mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在______(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是__________(填标号)。
a.CF4 b.CH4 c.NH![]() d.H2O
d.H2O

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A. Fe3+ B. Cu2+ C. Al3+ D. AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHCO3和Na2CO3是常见的钠盐,下列对它们的俗名、分类和用途描述不正确的是( )
A.NaHCO3可做治疗胃酸过多的药剂B.Na2CO3俗名纯碱,属于碱
C.Na2CO3可用于清洗餐具上的油污D.NaHCO3可用于泡沫灭火器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 1 mol乙烷和1 mol乙烯中,化学键数相同
C. 1 mol D2O与1 mol H2O中,中子数比为2∶1
D. 同等质量的氧气和臭氧中,电子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com