
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
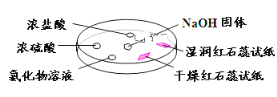
选项 | 实验现象 | 解释 |
A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是( )

A. 硅太阳能电池供电原理与该电池相同
B. 光照时, H+由a极区经质子交换膜向b极区迁移
C. 光照时,b极的电极反应式为 VO2+-e-+H2O=VO2++2H+
D. 夜间无光照时,a极的电极反应式为V3++e-=V2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
A. Na+(g)+Cl-(g) NaCl(s); △H1 B. Na(s)+![]() Cl2(g) NaCl(s); △H2
Cl2(g) NaCl(s); △H2
C. Na+(l)+Cl-(l) NaCl(s); △H3 D. Na(g)+ ![]() Cl2(g) NaCl(s); △H4
Cl2(g) NaCl(s); △H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图。已知该分子中N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法不正确的是( )

A. 该分子中既含有非极性键又含有极性键
B. 分子中四个氮原子不共平面
C. 该物质既有氧化性又有还原性
D. 15.2g 该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
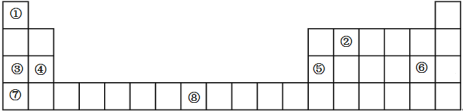
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________。
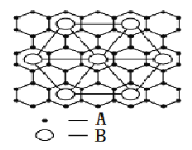
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________。
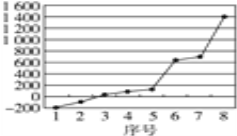
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______(填元素符号);其中电负性最大的是______(填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
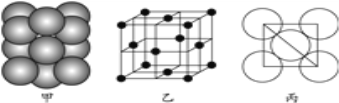
若已知⑤号元素原子半径为d cm,NA代表阿伏加德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的正极反应式为________________________。
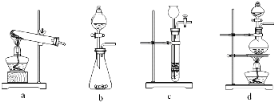
(2)已知草酸分解的化学方程式为:H2C2O4![]() CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
(3)某实验小组利用草酸分解产生的CO和铁锈反应来测定铁锈样品的组成(假定铁锈中只有Fe2O3· nH2O和Fe两种成份),实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、________(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是___________________________________________________________ 。
④准确称量样品10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请用化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为____________________________________________。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为_________________。写出在空气中长期放置生成H的化学反应方程式为:___________________________________。H的溶液与稀硫酸反应产生的现象为____________________________________。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________________________________。
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为_______________;原NaOH溶液的物质的量浓度为____________;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com