
【题目】2005年法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车顶采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成的五层膜材料(如图所示)。其工作原理是:在外接电源(外加电场)下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。下列有关说法中不正确的是( )
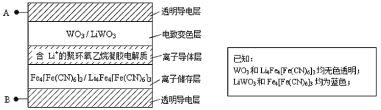
A.当A外接电源正极时,Li+脱离离子储存层
B.当A外接电源负极时,电致变色层发生反应为:WO3+Li++e-=LiWO3
C.当B外接电源正极时,膜的透过率降低,可以有效阻挡阳光
D.该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是( )

A.WX的水溶液呈碱性
B.元素非金属性的顺序为:Y>Z>Q
C.由X、Y、Q、W四种元素形成的化合物的水溶液一定呈碱性
D.该化合物中与Y单键相连的Q满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是

A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 2 min末的反应速率v(C)=0.3 mol·L-1·min-1
C. 2 min内D的物质的量增加0.2mol
D. 若起始时A、B的物质的量之比为4:3,则2 min末A、B的转化率之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用有机物X在一定条件下可合成植物生长所需的“平衡因子”Y(部分产物未写出)。已知含有“手性碳原子”的分子可形成对映异构体。下列有关说法中正确的是( )
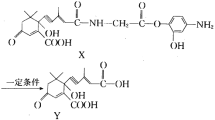
A.X,Y分子都不存在对映异构体
B.X分子中所有碳原子可能都在同一平面
C.Y分子可以发生取代、酯化、消去、加成、氧化等反应
D.未写出的产物可能有2种,且都具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个图象的说法中正确的是( )
A.①表示等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,其产生的氢气总体积(V)与时间(t)的关系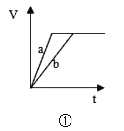
B.②表示合成氨反应中,每次只改变一个条件,得到的反应速率v与时间t的关系,则t3时改变的条件为增大反应容器的体积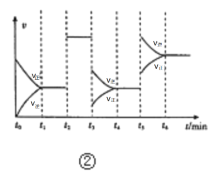
C.③表示其它条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化情况,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化情况,则D一定是气体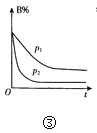
D.④表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态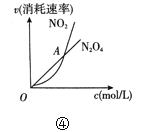
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-110kJmol-1
2NO2(g) ΔH=-110kJmol-1
T1℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中(忽略NO2与N2O4的转化)。
(1)下列可以作为反应已经到达平衡状态的判断依据的是____。
A.2v正(O2)=v逆(NO2)
B.NO与O2的物质的量之比为2:1
C.容器内混合气体的密度保持不变
D.K不变
E.容器内混合气体的颜色保持不变
(2)通过现代科学技术动态跟踪反应的进行情况,得到容器内混合气体的压强、平均摩尔质量随反应时间的变化曲线如图1图2所示。则反应2NO(g)+O2(g)![]() 2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
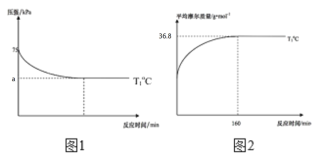
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH1
N2(g)+2H2O(g) ΔH1
已知在标准状况下,由元素最稳定的单质生成1mol纯化合物时的焓变叫做标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJmol-1、-280kJmol-1。则ΔH1=____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2。已知难溶物在溶液中并非绝对不溶,同样存在着一定程度的沉淀溶解平衡。在CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率,请用平衡移动原理解释其主要原因____。
(5)电化学处理法
工业上以多孔石墨为惰性电极,稀硝酸铵溶液为电解质溶液,将NO分别通入阴阳两极,通过电解可以得到浓的硝酸铵溶液。则电解时阳极发生的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
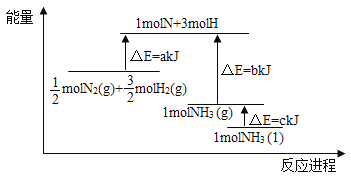
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com