
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应
【答案】A
【解析】
A、试验2、3中主要反应为:![]() ,由于试验2中的n(NH4+)大于试验3中的n(NH4+),而镁是过量的,所以不能得出
,由于试验2中的n(NH4+)大于试验3中的n(NH4+),而镁是过量的,所以不能得出![]() 浓度越大,反应速率越快的结论,故A符合题意;
浓度越大,反应速率越快的结论,故A符合题意;
B、由试验1、2对比可知,反应速率加快,其原因有可能是Na+、Cl-具有催化作用,由试验4、5对比可知,Na+对反应无催化作用,由此可知,Cl-对镁和水的反应有催化作用,故B不符合题意;
C、试验7中NH4Cl浓度较试验3高,产生氢气的速率应更快,但由表格可知,二者产生氢气的速率几乎相等,其原因在于试验7中加入了高浓度NH3·H2O,NH3·H2O与Mg2+反应生成了Mg(OH)2覆盖在镁表面,减慢反应,故C不符合题意;
D、由试验1、2、7对比可知,无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应,故D不符合题意;
都能加快镁和水的反应,故D不符合题意;
故答案为A。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
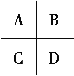
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=5时,Mn2+开始沉淀,MnS的溶度积为_______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
①在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
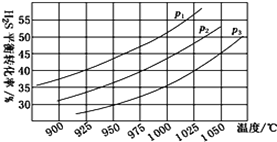
图中压强p1、p2、p3由大到小的顺序为________________________________。
②若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=____。
③若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=__________________(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车顶采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成的五层膜材料(如图所示)。其工作原理是:在外接电源(外加电场)下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。下列有关说法中不正确的是( )
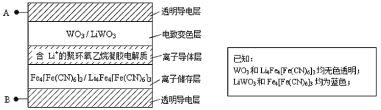
A.当A外接电源正极时,Li+脱离离子储存层
B.当A外接电源负极时,电致变色层发生反应为:WO3+Li++e-=LiWO3
C.当B外接电源正极时,膜的透过率降低,可以有效阻挡阳光
D.该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学校化学研究小组对实验室某废液缸里的溶液进行检测分析,提出假设:该溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、I-、SO42-等离子中的几种离子。实验探究:
①取少量该溶液滴加紫色石蕊试液,溶液变红。
②取100mL该溶液于试管中,滴加足量Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.3mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取100mL该溶液,逐渐加入Na2O2粉末,产生的沉淀和气体与所加Na2O2粉末物质的量的关系曲线如图所示。下列说法中不正确的是( )
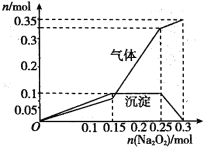
A.该溶液中一定不含有I-、HCO3-、Cl-
B.该溶液中一定含有K+,其物质的量浓度为1molL-1
C.在溶液中加入0.25~0.3molNa2O2时,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑、Al(OH)3+NaOH=NaAlO2+2H2O
D.该溶液能使紫色石蕊试液变红的唯一原因是NH4+发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学原理正确的是( )
A. 沸点:HF>HCl>HBr>HI
B. 一定条件下![]() 可以自发进行,则
可以自发进行,则![]()
C. 常温下,![]() 溶液加水,水电离的
溶液加水,水电离的![]() 保持不变
保持不变
D. 标况下,1mol![]() 分别与足量Na和
分别与足量Na和![]() 反应,生成气体的体积比为
反应,生成气体的体积比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
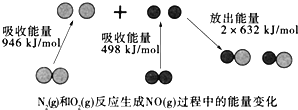
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com