
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
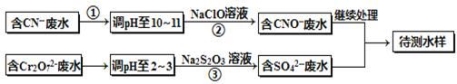
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5, a = 10
C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
(1)氧化还原法
(2)CN-+ClO-=CNO-+Cl-
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
因为:KSP(CuS)<KSP[Cu(OH)2]
(5)D
【解析】(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。
(4)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq)。
(5)设最终生成了ymol混合物,由于Cr元素量不变,则有(2-x)y=2,Fe元素不变,则有(1-x)y=a,铁失去的电子物质的量等于Cr得到的电子的物质的量相等,有x=1.5,y=4,a=10。答案选D。


科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:填空题
草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化: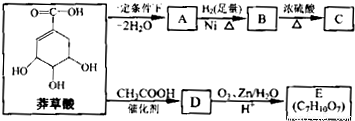
已知:①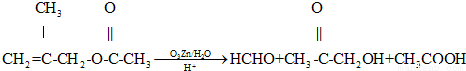
请回答下列问题;
(1)A的结构简式是 ;
(2)B→C的化学方程式是 ,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降
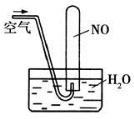
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
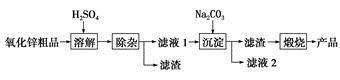
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c( HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、 SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +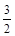 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) + O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
A、升高温度,可使①②反应速率均加快
B、室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C、NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l) ΔH = -346kJ/mol
D、1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项 | 离子组 | 加入试剂 | 离子方程式 |
A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+2NH4++Ba2++2OH-===BaSO4↓+2NH3·H2O |
B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-===2H2O+Mg(OH)2↓+2CO32- |
C | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2===CO32-+H2O |
D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+===SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列说法正确的是( )
A、煤的液化和气化都是物理变化
B、乙醇、乙酸和甲醛广泛应用于食品加工
C、蛋白质、橡胶和塑料都是天然高分子
D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:填空题
【物质结构与性质】
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:
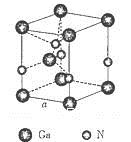
①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com