
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +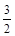 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) + O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
A、升高温度,可使①②反应速率均加快
B、室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C、NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l) ΔH = -346kJ/mol
D、1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
|
| R |
| |
T | Q |
| W | G |
A.离子半径:T< W< G
B.最简单气态氢化物的热稳定性:
C.最高价氧化物对应水化物的酸性:Q >W>G
D.T和G组成的化合物甲溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:简答题
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
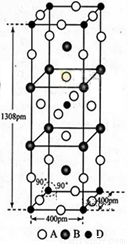
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是
A.1.36×10-5 mol·L-1
B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1
D.1×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
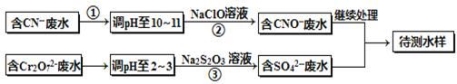
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5, a = 10
C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列有关物质的性质和该性质的应用均正确的是
A.NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体
B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
C.次氯酸钠具有强还原性,可用于配制“84”消毒液
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列化学用语表述正确的是( )
A、CH3COONH4的电离方程式为: CH3COONH4 CH3COO-+NH4+
CH3COO-+NH4+
B、NaHS的水解方程式为: HS-+H2O S2-+H3O+
S2-+H3O+
C、用过量的氨水吸收SO2的离子方程式为: 2NH3·H2O+SO2=2NH4++SO32-+H2O
D、过量Fe粉与Cl2反应的化学方程式为: Fe +Cl2FeCl2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
下列各组离子可能大量共存的是
A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、S2-、Br-
B.遇pH试纸变红色的溶液:Fe2+、S2O、SO42-、Na+
C.水电离出的c(H+) ?c(OH-) =10-28的溶液:Na+、S2-、NO3- 、SO32 -
D.能使KSCN显红色的溶液:Na+、NH4+、AlO、CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com