
【题目】一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。1799年,英国化学家汉弗莱·戴维发现了该气体。一氧化二氮早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。
(1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
△H=________(用含△H1、△H2的代数式表示)。
(2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g) ![]() CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O![]() FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g) ![]() 2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
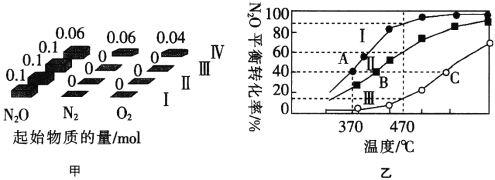
①该反应的△H______(填“>”或“<”)0。
②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为_______mol·L-1·s-1。
③已知容器I的体积为1L,370℃时,该反应的平衡常数k=________(保留两位有效数字)。
④图中A、B、C三点处容器内密度最大的点是________(填“A”“B”或“C”)。
【答案】![]() △H1 —
△H1 —![]() △H2 FeO+ +CO
△H2 FeO+ +CO ![]() Fe+ +CO2 小于 > 0.002 8.9×10-3 C
Fe+ +CO2 小于 > 0.002 8.9×10-3 C
【解析】
(1)利用盖斯定律书写出正确的热化学方程式,并计算出△H;
(2)根据催化剂的定义判断;第二步反应对总反应的速率没有影响,说明第一步是慢反应,控制总反应的速率;
(3)①由乙图可知,温度升高N2O的平衡转化率增大,据此判断;
②470℃下N2O的平衡转化率为60%,因此0~30sN2O转化了0.06mol,可计算出v(N2O),根据速率之比等于化学计量数之比可计算出v(O2);
③370℃时,容器I中N2O的平衡转化率为40%,利用三段法进行计算;
④A、B、C三点温度逐渐升高,而升高温度,平衡正向移动,据此分析判断。
(1)已知:①2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
根据盖斯定律可知,(①×2-②)×![]() ,可得2N2O(g)=2N2(g)+O2(g) △H=
,可得2N2O(g)=2N2(g)+O2(g) △H=![]() △H1 —
△H1 —![]() △H2;
△H2;
(2)根据催化剂的定义可知,第二步反应中,中间产物FeO+氧化CO生成CO2,而本身被还原为Fe+,反应为:FeO+ +CO ![]() Fe+ +CO2;第二步反应对总反应的速率没有影响,说明第一步是慢反应,控制总反应的速率,第二步反应速率大于第一步反应速率,因此第二步反应活化能小于第一步反应活化能;
Fe+ +CO2;第二步反应对总反应的速率没有影响,说明第一步是慢反应,控制总反应的速率,第二步反应速率大于第一步反应速率,因此第二步反应活化能小于第一步反应活化能;
(3)①由乙图可知,温度升高N2O的平衡转化率增大,说明平衡正向移动,而温度升高,平衡向吸热的方向移动,即该反应正向为吸热反应,△H>0;
②0~30sN2O转化了0.06mol,v(N2O)=![]() =
=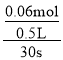 =0.004mol/(Ls),根据速率之比等于化学计量数之比可知v(O2)=
=0.004mol/(Ls),根据速率之比等于化学计量数之比可知v(O2)=![]() ×0.004mol/(Ls)=0.002mol/(Ls);
×0.004mol/(Ls)=0.002mol/(Ls);
③370℃时,容器I中N2O的平衡转化率为40%,那么
2N2O(g) ![]() 2N2(g) + O2(g)
2N2(g) + O2(g)
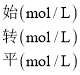
![]()
![]()
![]()
平衡常数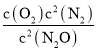 =
=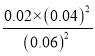 =8.9×10-3;
=8.9×10-3;
④A、B、C三点N2O的平衡转化率,温度越高,平衡正向移动趋势越大,容器内气体越多,容器内的密度越大,因此三点中C点的容器内密度最大。


科目:高中化学 来源: 题型:
【题目】天然化合物α-damascone可用于制作“香水”,其结构为: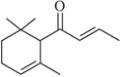 有关该化合物的下列说法不正确的是
有关该化合物的下列说法不正确的是
A.分子式为C13H20OB.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
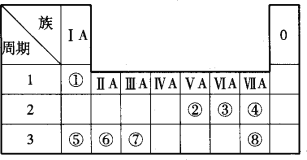
(1)在元素①~⑧中,非金属性最强的元素是____________(填元素名称)。
(2)在元素①~⑧中,原子半径最大的是___________(填元素名称)。
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的顺序排列是____________(用化学式表示)。
(4)用电子式表示元素①和⑧组成的化合物的形成过程____________。
(5)为验证ⅦA族部分元素非金属性的递变规律,设计了如图所示装置进行实验,请回答:
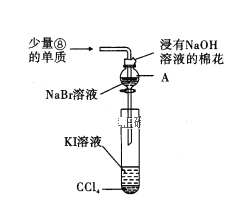
①仪器A的名称是_____, A中发生反应的离子方程式是_______。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)___________。
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____。
④ⅦA族元素非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,______,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种短周期元素,它们在周期表中的位置如图:
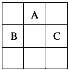
A原子核内质子数和中子数相等;B、C两元素原子核外电子数之和是A原子质量数的2倍。则:
(1)元素名称为A________、B________、C________。
(2)B和C最高价氧化物对应的水化物的化学式是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:
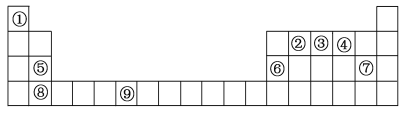
(1)上述元素中,属于s区的是__________ (填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图________。
(3)元素的第一电离能:③________④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(选填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中进行反应2X(g)+Y(g)![]() 2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,则反应经一段时间后,下列测定数据一定不正确的是( )
2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,则反应经一段时间后,下列测定数据一定不正确的是( )
A.c(X)=0.25mol·L-1
B.c(Y)=0.15mol·L-1
C.c(X)+c(Y)=0.4mol·L-1
D.c(Z)=0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七种第三周期元素,其浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
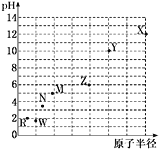
A.气态氢化物的稳定性:N>R
B.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
C.Z的最高价氧化物对应的水化物能溶于稀氨水
D.元素Y和R形成的化合物既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
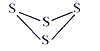
【题目】Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____kJ。
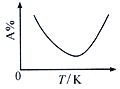
Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)![]() 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为_________(已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______点。
III. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
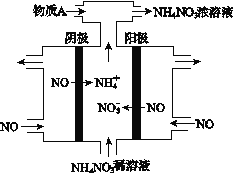
①阴极的电极反应式为_________________________。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的
的![]() 溶液中逐滴滴加
溶液中逐滴滴加![]() 的
的![]() 溶液。溶液
溶液。溶液![]() 随滴入
随滴入![]() 溶液体积变化如图所示。下列说法正确的是( )
溶液体积变化如图所示。下列说法正确的是( )
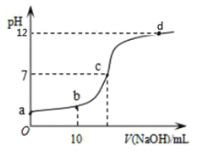
A.![]() 点的
点的![]()
B.![]() 点时,
点时,![]()
C.![]() 点时,
点时,![]()
D.从a→d,水的电离度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com