
【题目】下列说法中错误的是( )
A. Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质
B. 水溶液中,1 mol KCl比1 mol KClO3电离出的Cl-多
C. NH3溶于水后,溶液能够导电,但NH3是非电解质
D. NaHSO4溶于水电离方程式为NaHSO4===Na++H++SO![]()
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶上的有关数据,该浓盐酸中HCl的物质的量浓度为________mol/L。某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:

(2)该学生需要量取_______mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)_______、_______。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_____________________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1~2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是_____________________
A.摇匀后静置,发现液面低于刻度线,继续加水至与刻度线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼方法中,可制得相应金属单质的是 :
A. 工业上电解熔融MgO制镁 B. 加热分解Ag2O制银
C. 电解饱和食盐水制钠 D. 高温下分解CaCO3制钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如下:
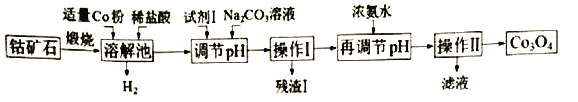
已知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
![]()
(l)写出溶解池中生成H2的离子反应方程式是____。
(2)加入试剂1的目的是将Fe2+氧化为Fe3+.试剂l可选用__ 。
A.氯化钠 B.双氧水 C.亚硫酸钠 D.碘水
(3)残渣l的主要成分为____。用浓氨水再调节pH,pH应略大于___ 。(已知:lg2=0.3.当离子浓度小于l.0×l0-5mol/L,可认为沉淀完全)。
(4)操怍Ⅱ包括____、____、干燥,灼烧四个步骤;灼烧中反应的化学方程式 _________。
(5)要得到15.0g质量分数为98%的LiCoO2正极材料,理论上需要Co3O4的质量为 __________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
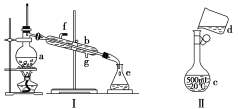
(1)写出下列仪器的名称:
a.________,b.________,c.________。
(2)仪器a~e中,使用前必须检查是否漏水的有________(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在________处。冷凝水由________(填“f”或“g”,下同)口通入,________口流出。
(4)现需配制0.125 mol·L-1 NaOH溶液450 mL,装置Ⅱ是某同学转移溶液的示意图。
①图中的错误是__________________。
除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有_________________________。
②根据计算得知,需称量NaOH的质量为__________________________g。称量时,往左盘烧杯中逐步添加药品至天平平衡,当只缺少量晶体时,其操作方法是_______________________________。
③下列操作使配制的NaOH溶液浓度偏低的有________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L浓硫酸配制100 mL 3.0mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③溶解;④转移、洗涤;⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是_________,(保留一位小数)量取浓硫酸所用的量筒的规格是________ 。(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100mL)
(2)第③步实验的操作是________________________________________。
(3)第⑤步实验的操作是______________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________;B.容量瓶用蒸馏水洗涤后残留有少量的水________;C.所用过的烧杯、玻璃棒未洗涤________;D.定容时俯视溶液的凹液面________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com