
【题目】将32.0 g铜与250 mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。(假定反应前后溶液体积不变,也不考虑N2O4的存在。)
试计算:
(1)硝酸的物质的量浓度是____________ molL-1
(2)若要使此混合气体被水完全吸收,需要通入标准状况下__________L O2。
【答案】6 5.6
【解析】
32.0 g铜的物质的量为![]() =0.5mol,11.2 L混合气体的物质的量为
=0.5mol,11.2 L混合气体的物质的量为![]() =0.5mol,设产生NO为xmol,NO2为ymol,由NO和NO2混合气体在标准状况下的体积为11.2 L可得x+y=0.5mol①,由得失电子数目守恒可得3x+y=1mol②,解联立方程可得x=0.25mol,y=0.25mol。
=0.5mol,设产生NO为xmol,NO2为ymol,由NO和NO2混合气体在标准状况下的体积为11.2 L可得x+y=0.5mol①,由得失电子数目守恒可得3x+y=1mol②,解联立方程可得x=0.25mol,y=0.25mol。
(1)由N原子个数守恒可得,n(HNO3)=n(NO)+n(NO2)+n(NO3—)=0.25mol+0.25mol+0.5mol×2=1.5mol,则硝酸的物质的量浓度是![]() =6 molL-1,故答案为:6;
=6 molL-1,故答案为:6;
(2)由得失电子数目守恒可知,混合气体被水完全吸收时,4 n(O2)= 3n(NO)+n(NO2)=3×0.25mol+1×0.25mol=1mol,则n(O2)=0.25mol,V (O2)=0.25mol×22.4L/mol=5.6L,故答案为:5.6.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】"绿色化学"的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是
A.工业生产环氧乙烷:2CH2=CH2+O2![]()
![]()
B.水煤气合成甲醇:CO+ 2H2 ![]() CH3OH
CH3OH
C.铝热反应:2Al+ Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D.合成甲基丙烯酸甲酯:![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.氢氧燃料电池的能量转换形式仅为化学能转化为电能
B.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率
C.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
D.在一密闭容器中发生2SO2+O2![]() 2SO3反应,增大压强,平衡会正向移动,
2SO3反应,增大压强,平衡会正向移动,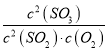 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.保存氯化亚铁溶液时,在溶液中加入少量稀盐酸,以防止Fe2+水解
B.同温时,等浓度的NaHCO3和Na2CO3溶液, Na2CO3溶液的pH大
C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
D.加热CH3COONa溶液,溶液中![]() 的值将减小
的值将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应;
(1)测得反应放出的热量_____92.4kJ (填“小于”,“大于”或“等于”)
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_____。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将__________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)2NH3(g) △H=﹣92.4kJ/mol 在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
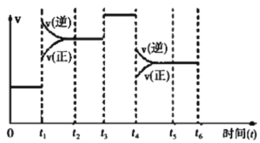
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1__________,t3__________,t4__________。
(2)下列时间段中,氨的百分含量最高的是_______
A.0~t1B.t2~t3 C.t3~t4D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4= FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A_______B_______(填“能”或“不能”)
(2)根据下图填空

①负极为___________,该电极的方程式为__________________
②正极的现象是________________________________,发生____________________反应(填写“氧化”或“还原”)
③电子从_____经导线流向_______,溶液中H+向________移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com