
【题目】"绿色化学"的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是
A.工业生产环氧乙烷:2CH2=CH2+O2![]()
![]()
B.水煤气合成甲醇:CO+ 2H2 ![]() CH3OH
CH3OH
C.铝热反应:2Al+ Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D.合成甲基丙烯酸甲酯:![]()
![]()
![]()
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。(请填写元素符号)
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的最外层电子构型____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中,保持一定的温度发生下列反应:4A(g)+B(?)2C(g)+2D(g),请用“增大”“减小”“不变”或“能”“不能”填空。
(1)当B为固体时,若反应向右进行,容器内混合气体的密度___________;若反应向左进行,容器内混合气体的密度___________;当容器内混合气体的密度不变时___________说明反应已经达到平衡。
(2)当B为气体时,不论向哪个方向反应,容器内混合气体的密度___________,故当容器内混合气体的密度不变时___________说明反应已经达到平衡。
(3)当B为固体时,无论向哪个方向反应,容器内混合气体的压强___________,故当容器内混合气体的压强不变时___________说明反应已经达到平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:

已知:
i.RCH2Br ![]() R—HC=CH—R×
R—HC=CH—R×
ii.R—HC=CH—R× 

iii. R—HC=CH—R×![]()

(以上R、R×、R代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是______。
(2)B所含官能团的名称是______。
(3)由C生成D的化学方程式是______。
(4)由G生成H的反应是_____反应,1molF与足量NaOH溶液反应,消耗_____molNaOH。
(5)与 互为同分异构体,且符合下列条件的有机物有______种。
互为同分异构体,且符合下列条件的有机物有______种。
①与 含有相同的官能团
含有相同的官能团
②酸性条件下的水解产物能使FeCl3溶液显紫色
③苯环上只有两个取代基
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成CH3CH=CHCH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:

(1)步骤II中制氢气原理如下:
![]()
![]()
恒容容器中,对于以上反应,能加快反应速率的是______.
![]() 升高温度
升高温度![]() 充入He
充入He![]() 加入催化剂
加入催化剂![]() 降低压强
降低压强
(2)天然气中的![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() ,一定条件下向
,一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
(3)![]() 和
和![]() 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成![]() ,反应的化学方程式______
,反应的化学方程式______![]() 以
以![]() 、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
(4)已知![]()
![]() ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为![]() 时,100吨甲烷为原料能够合成______吨尿素.
时,100吨甲烷为原料能够合成______吨尿素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|

(1)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________.
(2)饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有:____________/span>.
的原因有:____________/span>.
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(3)生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在____________
,在____________![]() 填温度范围
填温度范围![]() 下析出____________
下析出____________![]() 填化学式
填化学式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0 g铜与250 mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。(假定反应前后溶液体积不变,也不考虑N2O4的存在。)
试计算:
(1)硝酸的物质的量浓度是____________ molL-1
(2)若要使此混合气体被水完全吸收,需要通入标准状况下__________L O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:

已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问題:
(1)下列操作或描述正确的是 _________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________

①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________(填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中髙温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶中加入过量乙醇、浓硫酸和4.5g冰醋酸,再加入2~3片碎瓷片。开始缓慢加热圆底烧瓶,回流50分钟。待反应液冷至室温后,倒入分液漏斗中,依次用水、饱和Na2CO3溶液和水洗涤,分液后的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体。最后进行蒸馏,收集77~78℃馏分,得到乙酸乙酯产品5.28g。
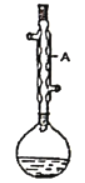
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)仪器A的名称是________
(2)在烧瓶中加入乙醇和浓硫酸的先后顺序是_______
(3)在洗涤操作中,Na2CO3溶液洗涤的主要目的是_______
(4)本实验中,乙酸乙酯产品的产率为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com