
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:

(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:___________________________
【答案】Fe O2 2Na2O2+2H2O=4NaOH+O2↑ Fe3++3OH-=Fe(OH)3↓ KSCN或NaOH 溶液变红或产生红褐色沉淀
【解析】
根据题给信息:A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀,结合物质之间的转化关系,可推断出J为Fe(OH)3,E为Na2O2,F为H2O,G为NaOH,D为O2,由此可判断出A为Na,B为Cl2,C为NaCl,I为FeCl3,H为Fe。据此进行分析。
(1)由分析可知,H为Fe,D为O2,答案为:Fe;O2;
(2)①Na2O2和水反应生成NaOH和O2,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;答案为:2Na2O2+2H2O=4NaOH+O2↑;
②FeCl3和NaOH发生复分解反应生成Fe(OH)3和NaCl,离子方程式为:Fe3++3OH-=Fe(OH)3↓;答案为:Fe3++3OH-=Fe(OH)3↓;
(3)利用Fe3+与KSCN反应生成血红色物质或Fe3+能跟碱反应生成红褐色沉淀等特征反应来检验Fe3+的存在,故答案为:KSCN或NaOH;溶液变红或产生红褐色沉淀。


科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法错误的是
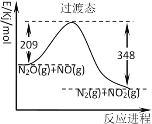
A.使用催化剂可以降低过渡态的能量
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ
D.反应物的键能总和大于生成物的键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET),俗称涤纶树脂,是一种重要的有机高分子材料。其结构为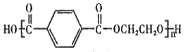 。利用有机物A合成PET的路线如图。
。利用有机物A合成PET的路线如图。
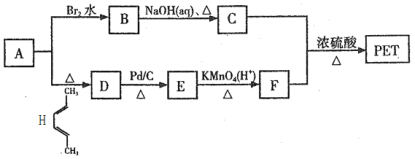
已知:①![]() ;②
;②![]() 。
。
根据题意回答下列问题:
(1)A的名称是_______,C中所含官能团的名称是______。
(2)H在一定条件下发生加聚反应生成顺式产物的结构简式___________。
(3)A→D、B→C的反应类型分别为______、______。
(4)写出C+F→PET的化学反应方程式________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有___种,写出其中2种的结构简式______。
(6)参照上述合成路线,以1,3-丁二烯为原料经3步制得丁苯橡胶。(无机试剂任选)
![]()
![]() I
I![]()
![]()
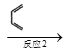
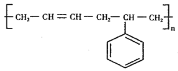
I的结构简式为_____;反应1的条件为_____;反应2的反应类型为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
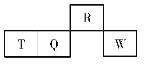
A.最高价氧化物对应水化物的酸性:Q<W
B.最简单气态氢化物的热稳定性:R>Q
C.原子半径:T>Q>R
D.含T的盐中,T元素只能存在于阳离子中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是
A. 2H2(g)+O2(g)→2H2O(g)+241.8kJ
B. H2(g)+1/2O2(g)→H2O(s)+241.8 kJ
C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJ
D. H2O(g)→H2(g)+1/2O2(g)-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.在常温常压下,11.2L Cl2含有的分子数为0.5NA
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.标准状况下,11.2LH2O含有的电子数为5NA
D.常温下,28gN2和CO混合气体中原子个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
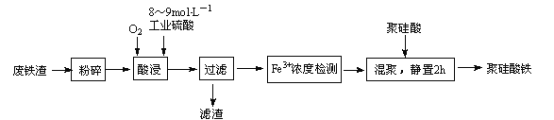
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组选用下列装置,利用反应![]() ,通过测量生成水的质量
,通过测量生成水的质量![]() 来测定Cu的相对原子质量。实验中先称取氧化铜的质量
来测定Cu的相对原子质量。实验中先称取氧化铜的质量![]() 为a g。
为a g。
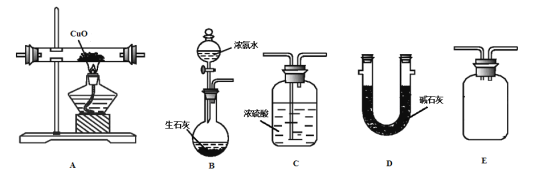
(1)浓氨水滴入生石灰中能制得NH3的原因是______________。
(2)甲同学按B-A-E-C-D的顺序连接装置,该方案是否可行__________,理由是_______________。
(3)乙同学按B-A-D-E-C的顺序连接装置,则装置C的作用是___________________________。
(4)丙同学认为乙同学测量的![]() 会偏高,理由是_____,你认为该如何改进?___
会偏高,理由是_____,你认为该如何改进?___
(5)若实验中测得![]() g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
(6)若CuO中混有Cu,则该实验测定结果_________。(选填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com