
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
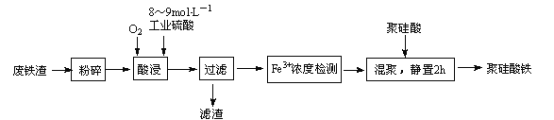
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。
【答案】减小颗粒直径,增大浸取时的反应速率和提高铁浸取率 烧杯、漏斗、玻璃棒 <2 氧化Fe2+为Fe3+ 温度超过100℃时,Fe3+水解反应速率明显加快,导致Fe3+浓度降低 C Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O 52%
【解析】
主要成分为Fe和Fe3O4、少量碳的废铁皮粉碎后用工业硫酸溶解,同时通入氧气,其中C不溶于稀硫酸,过滤后所得滤渣为C,而滤液中主要含有Fe3+,经检测Fe3+后,再加入聚硅酸,静置后即可得聚硅酸铁;
(1)对废铁渣进行粉碎的目的:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率,故答案为:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)在实验室进行过滤操作时,要用漏斗过滤,玻璃棒引流,烧杯接滤液,所以要用到的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)①因Fe3+在pH=2 开始沉淀,pH=3.7 沉淀完全,则酸浸时应调节溶解的pH<2,防止溶液pH≥2时将有部分Fe3+沉淀损失,故答案为:<2;pH≥2时将有部分Fe3+沉淀损失;
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子,故答案为:氧化Fe2+为Fe3+
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低,故答案为:温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
(4)废铁皮(主要成分Fe和Fe3O4,少量碳),在通氧气的条件下,用硫酸酸浸,Fe和Fe3O4与硫酸反应,而碳不溶解,过滤后滤渣的主要成分为碳,故答案为:C;
(5)在酸性条件下,用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;由方程式可知,n(Fe2+)=6n(Cr2O72-)=6×0.2000 mol/L×0.020L,则铁元素的百分含量为![]() ×100% ≈52%,故答案为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;52%。
×100% ≈52%,故答案为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O;52%。


科目:高中化学 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
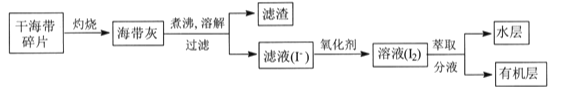
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:

(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
A.氖元素的相对原子质量一定是![]()
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量一定是![]() mol
mol
D.Wg该氖原子所含质子数是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.0gNaOH固体溶于水配成100mL溶液,其密度为1.20g﹒mL-1。试计算:.
(1)该溶液中NaOH的物质的量浓度为______。
(2)该溶液中NaOH的质量分数为______。。
(3)从该溶液中取出10mL,其中含NaOH的质量为___。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律。
(提出猜想)小组提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查阅资料得知,NO2可被NaOH溶液吸收,反应的化学方程式为:_________。
(2)实验前,小组成员经讨论认定猜想丁不成立,理由是________。
(实验操作)
(3)设计如图装置,用氮气排尽装置中空气,其目的是_______;加热Mg(NO3)2固体,AB装置实验现象是:________,说明有Mg(NO3)2固体分解了,有NO2生成。

(4)有同学提出可用亚硫酸钠溶液检验是否有氧气产生,但通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,其作用是:_______。
(5)小组讨论后认为即便通过C后有氧气,仅仅用亚硫酸钠溶液仍然难以检验,因为:______,改进的措施是可在亚硫酸钠溶液中加入_______。
(6)上述系列改进后,如果分解产物中有O2存在,排除装置与操作的原因,未检测到的原因是______。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯与甲苯为主要原料,按下列路线合成一种香料W:

(1)实验室制备乙烯的反应试剂与具体反应条件为____。
(2)上述①~④反应中,属于取代反应的是___。
(3)检验反应③是否发生的方法是____。
(4)写出两种满足下列条件的![]() 同分异构体的结构简式。____、____。
同分异构体的结构简式。____、____。
a.能发生银镜反应 b.苯环上的一溴代物有两种
(5)设计一条由乙烯制备A的合成路线。(无机试剂可以任选)____。
(合成路线常用的表示方式为: )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)0.1 mol/L Al2(SO4)3溶液100mL与0.3mol/LK2SO4溶液200mL混合,则所得溶液中硫酸根离子的物质的量浓度为__________。(混合后,忽略体积变化)
(3)相同质量的SO2、SO3的氧原子的个数之比为____,体积比_______。
(4)液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是336mL,密度是2.56g/L.
①反应前O2的体积是_____mL(标准状况),化合物XY2的摩尔质量是_____.
②若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_____和_____(写元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com