
【题目】下列分子的VSEPR模型与分子的立体构型相同的是( )
A.CCl4B.SO2C.NH3D.H2O
【答案】A
【解析】
A.CCl4中碳原子价层电子对个数=4+![]() ×(4-4×1)=4,所以C原子采用sp3杂化,VSEPR模型为正四面体结构,不含有孤电子对,所以其空间构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故A正确;
×(4-4×1)=4,所以C原子采用sp3杂化,VSEPR模型为正四面体结构,不含有孤电子对,所以其空间构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故A正确;
B.SO2中孤对电子为![]() =1,σ 键电子对为2,价层电子对个数=1+2=3,S原子采取sp2杂化,VSEPR模型为平面三角形结构,含有1个孤电子对,空间构型为V形,VSEPR模型与分子立体结构模型不一致,故B错误;
=1,σ 键电子对为2,价层电子对个数=1+2=3,S原子采取sp2杂化,VSEPR模型为平面三角形结构,含有1个孤电子对,空间构型为V形,VSEPR模型与分子立体结构模型不一致,故B错误;
C.氨气分子中氮价层电子对个数=σ键个数+孤电子对个数=3+![]() (5-3×1)=4,VSEPR模型为正四面体结构,含有1个孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,故C错误;
(5-3×1)=4,VSEPR模型为正四面体结构,含有1个孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,故C错误;
D.水分子中氧原子价层电子对个数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,空间构型是V型,VSEPR模型与分子立体结构模型不一致,故D错误;
×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,空间构型是V型,VSEPR模型与分子立体结构模型不一致,故D错误;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
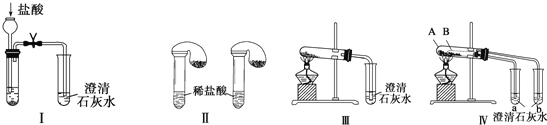
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)_____。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)____________。
a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全 c.Ⅳ比Ⅲ操作简便 d.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为_________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pAg+=lgc(Ag+),pX=lgc(X)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
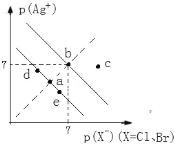
A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×1014 mol2·L2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br(aq)![]() AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. HF的电子式:![]() B. 用核素符号表示中子:
B. 用核素符号表示中子:![]()
C. HClO的结构式:H-Cl-O D. 用电子式表示CO2的形成过程: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式______________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是
A. 113号元素的氧化物为两性氧化物
B. 115号元素位于第六周期第VA族
C. 117号元素的某种原子,核内含176个中子,此原子是![]() Ts
Ts
D. 118号元素的原子最外层有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )

A.X是正极,Y是负极,CuSO4溶液的pH逐渐减小
B..X是正极,Y是负极,CuSO4溶液的pH保持不变
C.X是负极,Y是正极,CuSO4溶液的pH 逐渐减小
D.X是负极,Y是正极,CuSO4溶液的pH保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com