
【题目】常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( ) 
A.由题可知HA为弱酸
B.滴定终点位于c和d点之间
C.滴定到b点时:n(Na+)+n(H+)﹣n(OH﹣)+n(HA)=0.002mol
D.滴定到d点时:c(OH﹣)>c(Na+)>c(A﹣)>c(H+)
【答案】B
【解析】解:A、20mL0.1mol/LHA溶液pH=3,所以酸是弱酸,故A正确;B、向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,恰好中和时溶液呈碱性,pH>7,溶液呈中性,需要酸稍过量,滴定终点位于c和b点之间,故B错误;
C、滴定到b点时,根据电荷守恒:n(Na+)+n(H+)﹣n(OH﹣)=n(A﹣),n(A﹣)+n(HA)=0.002mol,即n(Na+)+n(H+)﹣n(OH﹣)+n(HA)=0.002mol,故C正确;
D、d点所的溶液是氢氧化钠和醋酸钠溶液的混合物,所以c(Na+)>c(A﹣),氢氧化钠剩余,c(Na+)>c(OH﹣)>c(A﹣)>c(H+),故D正确,
故选B.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是( )
A.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 molL﹣1500 mLNaOH溶液
D.常温常压下测得1 mol N2的质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用. 请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣12C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是 , 该反应自发进行的条件 .
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比). 反应ⅠCO2(g)+4H2(g)CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g)△H5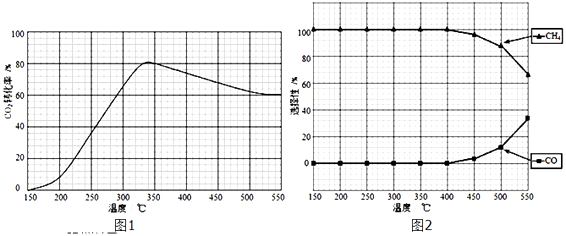
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为(用a、V表示)
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线. 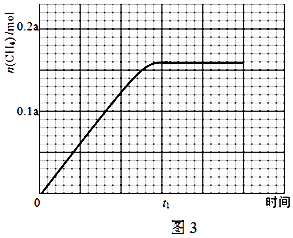
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2 , 氮元素显﹣3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( ) 
A.H十透过质子交换膜由左向右移动
B.铜电极应与Y相连接
C.M电极反应式:H2NCONH2+H2O﹣6e﹣═CO2↑+N2↑+6H+
D.当N电极消耗0.25 mol气体时,则铁电极增重16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O。则RO4n-中R 的化合价是
A. +3 B. +4 C. +5 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升?______________
(2)反应后溶液中H+ 的浓度是多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,能达到实验目的的是( )
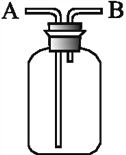
A. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
B. 从B口进气,用排空气法收集SO2
C. 瓶中盛满水,从B口进气,用排水法收集NO2
D. 瓶中盛满水,A口连接导管并伸入量筒中,从B口进气用排水法测量生成NO的体积,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
(1)混合物中NaOH的物质的量为 ,
(2)混合物中AlCl3质量为 ,
(3)混合物中MgCl2质量为 ,
(4)P点表示盐酸的体积是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com