
����Ŀ��C��N��O��Al��Si��Cu�dz���������Ԫ�أ�
��1��Siλ��Ԫ�����ڱ������ڵ��壮
��2��Nԭ�ӵ�ԭ�ӽṹʾ��ͼΪ��Cu�ĵͼ����������ɫΪ ��
��3���á�����������գ�
ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
AlSi | NO | ���ʯ����� | CH4SiH4 |
��4�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ��������� 
0��t1ʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ�� �� ��Һ�е�H+�����ƶ���t1ʱ��ԭ����е��������������ı䣬��ԭ���� ��
���𰸡�
��1������IVA
��2��![]() ��ש��ɫ
��ש��ɫ
��3����������������
��4��2H++NO3��+e��=NO2��+H2O����������Ũ�����з����ۻ�������Ĥ��ֹ��Al��һ��������Ӧ��Al��������������Ũ�Ƚ�Ϊһ��Ũ��ʱ��Ϊϡ���ᣬAl��ʼ�����������������������ı�
���������⣺��1��Siԭ�Ӻ�����3�����Ӳ㡢����������Ϊ4������λ�ڵ������ڵ�IVA�壬�ʴ�Ϊ��������A����2��Nԭ�ӽṹʾ��ͼΪ ![]() ��������ͭΪש��ɫ���ʴ�Ϊ��
��������ͭΪש��ɫ���ʴ�Ϊ�� ![]() ��ש��ɫ����3��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С������ԭ�Ӱ뾶Al��Si��
��ש��ɫ����3��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С������ԭ�Ӱ뾶Al��Si��
ͬһ����Ԫ�ص縺������ԭ������������������Ե縺��N��O��ԭ�Ӿ����۷е���ԭ�Ӱ뾶�ɷ��ȣ�ԭ�Ӱ뾶C��Si�������۷е���ʯ������裻��������ķ��Ӿ����۷е�����Է������������ȣ���Է����������飼���飬�����۷е���飼���飻
ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
Al��Si | N��O | ���ʯ������� | CH4��SiH4 |
4����ԭ����У�Al�����ۻ�����Cu��ʧ���Ӷ���������Al��������������ӦʽΪ2H++NO3��+e��=NO2��+H2O����Һ���������������ƶ��������������������ƶ�����Ũ����Ũ�Ƚ��͵�һ���̶��DZ�Ϊϡ���ᣬAl��ʧ���Ӷ������������Ե��������������ı䣬�ʴ�Ϊ��2H++NO3��+e��=NO2��+H2O����������Ũ�����з����ۻ�������Ĥ��ֹ��Al��һ��������Ӧ��Al��������������Ũ�Ƚ�Ϊһ��Ũ��ʱ��Ϊϡ���ᣬAl��ʼ�����������������������ı䣮
��1������Ԫ��ԭ�Ӻ�����Ӳ���������������ȣ�����������������������ȣ���2��Nԭ�Ӻ�����7�����ӡ�������7�����ӡ��������Ӳ㣻������ͭΪש��ɫ����3��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С��ͬһ����Ԫ�ص縺������ԭ���������������ԭ�Ӿ����۷е���ԭ�Ӱ뾶�ɷ��ȣ���������ķ��Ӿ����۷е�����Է������������ȣ���4����ԭ����У�Cu��������Al����������������������ӵõ������ɶ����������������Һ���������������ƶ������������ƶ�����Ũ����Ũ�Ƚ��͵�һ���̶��DZ�Ϊϡ���ᣬAl��ʧ���Ӷ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Xԭ�ӵĺ˵����Ϊa������������Xm����Yԭ�ӵ�������Yn���ĵ��Ӳ� �ṹ��ͬ����Yԭ�ӵĺ˵����Ϊ�� ��
A.a��m��nB.a��m��nC.m��n��aD.m��n��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ���������A��B��һ���¶��·�����ӦA��g��+xB��g��2C��g�����ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��仯��ͼ��ʾ������˵������ȷ���ǣ� �� 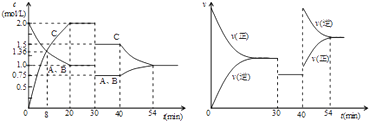
A.30minʱ�����¶ȣ�40minʱ����������C
B.0��8min��A��ƽ����Ӧ����Ϊ0.08mol/��Lmin��
C.��Ӧ����ʽ�е�x=1������ӦΪ���ȷ�Ӧ
D.20min��40min��÷�Ӧ��ƽ�ⳣ����Ϊ8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ��Լ����������ϩ���ֿ��Գ�ȥ�����л��е���ϩ���õ���������ķ�����
A. ������Cl2��Ӧ B. ͨ��������ˮ��
C. ��һ��������ͨ������ D. ͨ���������������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A����Ȼ������Ҫ�ɷ֣���AΪԭ����һ�������¿ɻ���л���B��C��D��E��F�����ת����ϵ��ͼ����֪��B�ڱ�״���µ��ܶ�Ϊ1.16gL��1 �� C�ܷ���������Ӧ��FΪ��Ũ����ζ����������ˮ����״Һ�壮 
��ش�
��1���л���D�к��еĹ����������� ��
��2��D+E��F�ķ�Ӧ������ ��
��3���л���A�ڸ�����ת��ΪB�Ļ�ѧ����ʽ�� ��
��4������˵����ȷ���� ��
A.�л���E������Ʒ�Ӧ��ˮ������Ʒ�ӦҪ����
B.�л���D��E��F���ñ���Na2CO3��Һ����
C.ʵ�����Ʊ�Fʱ��Ũ������Ҫ����������
D.�л���C�ܱ����Ƽ���������ͭ����Һ������KMnO4��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɴ�����Ⱦ��SO2��Ҫ��Դ�ڣ� ��
A.��ɽ�緢B.��Ȼ�纬����ķֽ������
C.�����ų��ķ���D.����ȼ�պ���ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20mL0.1mol/LHA��Һ����μ���0.1mol/LNaOH��Һ����pH�仯�����ͼ��ʾ�������¶ȱ仯��������˵���в���ȷ���ǣ� �� 
A.�����֪HAΪ����
B.�ζ��յ�λ��c��d��֮��
C.�ζ���b��ʱ��n��Na+��+n��H+����n��OH����+n��HA��=0.002mol
D.�ζ���d��ʱ��c��OH������c��Na+����c��A������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Դ�ǵ����о����ȵ����⣮�����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3 �� ��ҵ�Ʊ��������ڴ���Ӧ���У�ѹ��2.0��10.0Mpa���¶�230��280�棩�������з�Ӧ��
��CO��g��+2H2��g��CH3OH��g����H1=��99kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H2=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H3=��41.2kJmol��1
��1������Ӧ���е��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���������H= �� ��Ӧԭ������ú����������֪�÷�Ӧ��ƽ�ⳣ������ʽΪK= ![]() ��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���ڸ������£�����Ӧ�ٵ���ʼŨ�ȷֱ�Ϊ��c��CO��=0.6molL��1 �� c��H2��=1.4molL��1 �� 8min��ﵽƽ�⣬CO��ת����Ϊ50%����8min��H2��ƽ����Ӧ����Ϊ ��
��3����t��ʱ����Ӧ�ڵ�ƽ�ⳣ��Ϊ400�����¶��£���1L���ܱ������м���һ���ļ״�����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c��molL��1�� | 0.46 | 1.0 | 1.0 |
��ʱ��v��v�����������������=������ƽ��ʱc��CH3OCH3�������ʵ���Ũ���� ��
��4���ڣ�1��С���д���Ӧ�ҵ��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g����CO��ƽ��ת����a��CO�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��ͼ��X��������¶ȡ���ѹǿ�����жϵ������� 
��5���ڴ�����������ͬʱ����������Ӧ������������ʼͶ�ϱ� ![]() �ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�����У���ȷ���ǣ� ��
A. ������Ľṹʽ��H��O��Cl
B. �����ĵ���ʽ����N�áá�N��
C. CO2���ӵĵ���ʽ��O��C��O
D. �õ���ʽ��ʾ�Ȼ�����ӵ��γɹ��̣�![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com