
【题目】下列说法正确的是( )
A. 同一原子中,2p、3p、4p能级的轨道数依次增多
B. 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C. ![]() 表示的原子能量处于最低状态
表示的原子能量处于最低状态
D. 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )

A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了如图1探究:
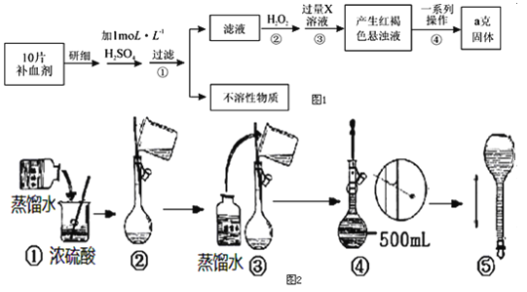
请回答下列问题:
Ⅰ实验时用10molL-1的浓硫酸配制100mL1molL-1H2SO4溶液,
(1)需用量筒量取____mL上述浓硫酸进行配制。
(2)所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀硫酸时,还缺少的玻璃仪器是____,该仪器所具备的功能是____(填序号)。
A.配制一定体积准确浓度的溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在图2配制过程示意图中,错误的有(填序号)_____。
(4)下列操作导致所配制的稀硫酸的物质的量浓度偏低的是______填字母)。
A、用量筒量取浓硫酸时俯视凹液面
B、将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
F、转移到容量瓶的过程中,有少量的溶液溅出
G、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中
H、用不干燥的量筒量取浓硫酸
Ⅱ(1)步骤③中产生的红褐色物质是(填化学式)_____。
(2)从红褐色的悬浊液到得到固体最后的称量,一系列过程中所需的基本操作为:
a.____,b.洗涤,c.灼烧,d.冷却。
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为____ g。
(4)写出步骤②的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)该有机物的分子式_______________,A的链状同分异构体共有__________种。
(2)A的链状同分异构体中含有支链的同分异构体的结构简式为_______________,其系统命名为__________________
(3)若该有机物跟HCl的加成产物只有一种,试确定其结构简式___________________
(4)若该有机物在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作为反应物,按下列反应类型各写一个化学方程式:
(1)化合反应___。
(2)置换反应___。
Ⅱ.按下列要求各写出一个化学反应的化学方程式(反应物自选):
(1)有水生成的化合反应___。
(2)由硝酸银生成硝酸铜的置换反应__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
Ⅰ.实验室研究氯化钠的性质及制备
(1)氯化钠固体不导电,但氯化钠溶液能导电,用化学用语解释氯化钠溶液能导电的原因:___。
(2)实验室检验Cl-的试剂是___。
(3)某同学用含钠元素的不同类别物质制备NaCl。化学反应方程式如下:
a.2Na+Cl2![]() 2NaCl
2NaCl
b.Na2O+2HCl=2NaCl+H2O
c.
d.Na2CO3+2HCl=2NaCl+CO2↑+H2O
①请补充c反应的化学方程式:___。
②也可用两种盐溶液相互反应获得氯化钠,该反应的化学方程式为___。
Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有Ca2+、Mg2+、SO42-等可溶性杂质。某同学设计了一种制备精盐的实验方案,步骤如下:

(4)写出下列各试剂的化学式
试剂1:___;试剂2:___;试剂3:___。
(5)步骤④中涉及到的离子方程式有:___。
(6)步骤⑦涉及的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mo1·L—1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mo1·L—1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________________。
(2)x =________。
(3)A的转化率与B的转化率之比为___________。
(4)下列各项可作为该反应达到平衡状态的标志的是_________。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
(5)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为 ________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com