
【题目】有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX4++WX-=ZX3+X2W,且反应物和产物中各微粒的电子总数与M+相等,均为10个;③Z2与YW分子中质子数相等。回答下列问题:
(1)YW2的电子式:______________;实验室中MWX溶液的保存方法是:________
(2)由X、Y、Z、W四种元素共同组成的离子化合物A,其原子个数比为5:1:1:3,则A的水溶液与足量的MWX溶液反应的离子方程式为:_________________________
(3)M2W2投入足量Na2S溶液中,生成浅黄色沉淀的离子方程式为:_______________
(4)与M同族的元素B和B2W共n 克投入到足量的X2W中完全反应,生成物蒸干后得1.25n 克化合物BWX,B是________(填元素名称)。
【答案】![]() 带橡皮塞的细口玻璃瓶 NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O Na2O2+Na2S+2H2O=4NaOH+S↓ 钾
带橡皮塞的细口玻璃瓶 NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O Na2O2+Na2S+2H2O=4NaOH+S↓ 钾
【解析】
X、Y、Z、W、M五种短周期元素,原子序数依次增大。根据ZX4++WX-═ZX3+X2W,且反应物和产物中各微粒的电子总数均为10个电子,则ZX4+为NH4+,WX-为OH-,ZX3+为NH3;X2W为H2O;M+电子数与NH4+、OH-、NH3、H2O相等,则M+为Na+;所以M为Na元素,X为H元素,Z为N元素,W为O元素;由于Z2与YW分子(YW分子为CO)中质子数相等则Y为C元素;结合元素及其单质、化合物的性质来解答。
根据ZX4++WX-═ZX3+X2W,且反应物和产物中各微粒的电子总数均为10个电子,则ZX4+为NH4+,WX-为OH-;ZX3为NH3,X2W为H2O;M+电子数与NH4+、OH-、NH3、H2O相等,则M+为Na+;所以M为Na元素,X为H元素,Z为N元素,W为O元素;由于Z2与YW分子(YW分子为CO)中质子数相等则Y为C元素;
(1)YW2为CO2,是共价化合物,其电子式为![]() ;M为Na元素,X为H元素,W为O元素,则MWX为NaOH,易吸收水和空气中的二氧化碳反应,氢氧化钠能与二氧化硅反应生成硅酸钠,硅酸钠是矿物胶,不能用玻璃塞,则应密闭保存在带橡胶塞的试剂瓶中;
;M为Na元素,X为H元素,W为O元素,则MWX为NaOH,易吸收水和空气中的二氧化碳反应,氢氧化钠能与二氧化硅反应生成硅酸钠,硅酸钠是矿物胶,不能用玻璃塞,则应密闭保存在带橡胶塞的试剂瓶中;
(2)由X、Y、Z、W四种元素共同组成的离子化合物A,其原子个数比为5:1:1:3,则A为NH4HCO3,MWX为NaOH,NH4HCO3溶液与足量NaOH溶液反应的离子方程式为NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O;
(3)M2W2是Na2O2,Na2O2有强氧化性,Na2O2投入足量Na2S溶液中,生成浅黄色沉淀是S,反应的化学方程式为:Na2O2+2H2O+Na2S=4NaOH+S↓;
(4)设B的相对原子质量为R,利用极限值法求解:
若ng的物质全为B时
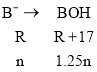
则:![]() =
=![]() ,解得R=68;
,解得R=68;
若ng物质全为B2O时

则:![]() =
=![]() ,解得R=28;
,解得R=28;
因为ng物质为B与B2O的混合物,故28<R<68,与Na同族的元素中只有K符合要求,故B为钾。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是![]()
A.稀硝酸与过量的铁屑反应:![]()
B.硫酸铝溶液与过量的氨水反应:![]()
C.苯酚钠的水溶液中通入少量的![]() :
:![]()
D.醋酸钠的水解反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合碱碳酸镁简称轻质碳酸镁【3MgCO3.Mg(OH)2.3H2O】,相对密度小,质轻而松,广泛用于橡胶制品、防火保湿材料和日货用品中等。一种以富含氯化镁。硫酸镁的卤水和白云石【CaMg(CO3)2】为原料的卤水碳化法生产轻质碳酸镁的工艺流程如下:
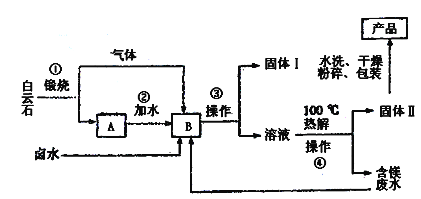
已知:MgCO3比CaCO3更易与CO2反应生成可溶性盐。
(1)为了使第①步白云石煅烧得更充分,常常要对矿石进行__预处理。
(2)第③步和第④步操作的名称是__,在实验室进行该操作时需要的玻璃仪器有
__。
(3)固体I的主要成分为____,固体II的主要成分为____。水洗固体II时,如何判断已经洗净,请简述其过程:____。
(4)写出第④步反应的化学方程式:____。
(5)该流程中能同体现提高效益、减少废物排放思想的两项设计是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molNa2O2与SO2完全反应,转移2NA个电子
B. 标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C. 18g的D2O中含有的中子数为10NA
D. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氯及其化合物的“价-类”二维图。
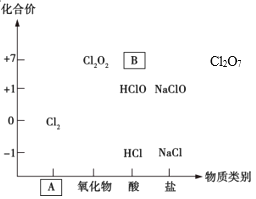
(1)填写二维图缺失的类别A_________和化学式B_________。
(2)某同学利用以下试剂研究HCl性质,进行了如下预测:
a.NaClO b.Fe c.NaOH d.KMnO4 e.AgNO3
从物质类别上看,HCl属于______,可能与__________发生反应(填序号);
从化合价角度看,Cl-具有______性,可能与_____发生反应(填序号)。
(3)某工厂用NaCl溶液制备氯气,其化学原理为如下反应:
![]() H2O +
H2O + ![]() NaCl == Cl2 +
NaCl == Cl2 + ![]() NaOH+
NaOH+![]()
①请将上述方程式补充完整,并用单线桥表示电子转移。_____________
②反应中NaCl作_________剂,理由是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法正确的是

A. Kb2的数量级为10-5
B. X(OH)NO3水溶液显酸性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
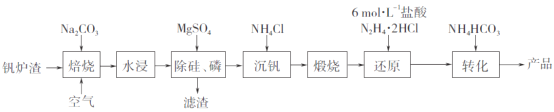
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物,用7.0 mol/L的盐酸100 mL在一定条件下恰好完全溶解,所得溶液中再通入0.56L标况下的Cl2时,刚好使溶液中的Fe2+全部转化为Fe3+,则该氧化物中Fe2+与Fe3+的物质的量之比为
A.1:4B.2:1C.4:1D.3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,容积为1 L的恒容密闭容器中,同时通入0.1 mol CO(g)和0.1 mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
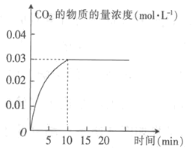
(1)0~10min内,CO的平均反应速率为_______________。
(2)T1温度下,该反应的平衡常数K为________(用分数表示)。
(3)①已知:
I.H2的燃烧热△H=-285.8 kJ· mol-1;
II.CO的燃烧热△H=-283 kJ· mol-1;
III.H2O(g)=H2O(l) △H=-44 kJ· mol-1。
则a=_______。
②反应达到平衡后,下列措施能使平衡向正反应方向移动的是__________(填字母)。
A 升高温度 B 增大压强 C 通入H2O(g) D 移走CO2(g)
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1,c(H2)=0.4 mol·L-1,c(CO2)=0.4 mol·L-1,则该反应在下-时刻将____(填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com