
【题目】下列说法中错误的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1mol金刚石晶体中,平均含有2molC—C键
C.构成单质分子的微粒之间不一定存在共价键
D.某气态团簇分子结构如图所示,该分子的分子式为EF或FE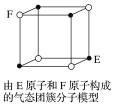
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为:___。 |
(2)将此4.5g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为:____。 |
(3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况)。 | (3)写出A中含有的官能团(用结构简式表示)____。 |
(4)A的核磁共振氢谱如图: | (4)综上所述,A的结构简式为________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:___。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | A的分子式为:___。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况)。 | 写出A中含有的官能团___、__。 |
(4)A的核磁共振氢谱如图: | 综上所述,A的结构简式为___。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前生产聚氯乙烯的方法是先使乙烯与氯气和氧气在一定条件下反应生成氯乙烯和水,再进一步合成聚氯乙烯。请回答
(1)请写出上述两个过程所发生反应的化学方程式:①____________________________,②__________________________________________。
(2)聚氯乙烯是一种可燃物,火灾中聚氯乙烯燃烧会产生有害气体,其主要成分可能是_________;若在火灾现场,为了防止气体中毒,应采取的防护措施是__________________________________________。
(3)聚氯乙烯___________(填“可以”或“不可以”)用于制作食品包装袋,原因是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为___。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为___,丙烯醇分子中碳原子的杂化类型为___。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是___。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)2]2-等。[Ni(NH3)6]2+中心原子的配位数是___,与SCN-互为等电子体的分子为___。
(6)“NiO”晶胞如图所示。
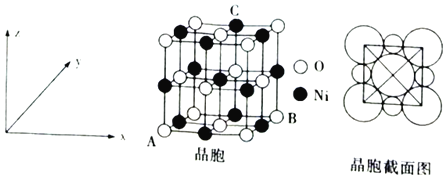
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___。
②已知:氧化镍晶胞密度为dgcm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为___nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 molL-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是

A. A、B、C三点所表示的溶液中水的电离程度依次增大
B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-)
C. 通入HCl, R-的水解程度增大,HR的电离常数减小
D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的重要标志。聚乙烯是以乙烯为原料合成的一种人们常用的高分子材料。下列有关叙述正确的是( )
A.乙烯合成聚乙烯的反应属于化合反应
B.乙烯合成聚乙烯的化学方程式是:nCH2=CH2 ![]()
![]()
C.聚乙烯在自然界中很难降解,容易导致“白色污染”
D.聚乙烯是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是

A. 该日空气首要污染物是PM10
B. 该日空气质量等级属于中度污染
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com