
【题目】亚氯酸(HClO2)是一种中强酸,易分解,亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。回答下列问题:
(1)HClO2中氯元素的化合价为_______;亚氯酸不稳定,易分解为Cl2、ClO2和H2O,分解后的氧化产物与还原产物的物质的量之比为__________________。
(2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH-![]() ClO2-+H2O在常温下的平衡常数K=_________________。
ClO2-+H2O在常温下的平衡常数K=_________________。
(3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:C12和ClO2溶于水后更易与SO2和NO反应。

①亚氯酸盐脱除SO2的离子方程式为________________________。
②pH越小,脱除率越大,其原因是____________________________________________。
【答案】 +3 6∶1 1.1×1012 2SO2 +C1O2-+2H2O==2SO42-+C1-+4H+ 亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出C1O2及Cl2,C1O2和Cl2溶于水可提高脱除率
【解析】(1)本题考查得失电子数目守恒和化学用语,HClO2中H显+1价,O显-2价,整个化合价代数和为0,即Cl显+3价,Cl→Cl2,化合价由+3价→0,因此Cl2为还原产物,Cl→+4价,化合价由+3价→+4价,化合价升高,ClO2为氧化产物,根据得失电子守恒,n(Cl2)×2×3=n(ClO2)×1,因此有n(ClO2):n(Cl2)=6:1;(2)考查平衡常数的计算,根据平衡常数的表达式,K=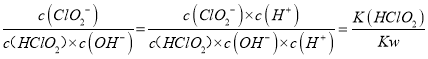 ,代入数值,解得K=1.1×1012;(3)本题考查氧化还原方程式的书写,①因为Cl2和ClO2能与SO2发生反应,因此ClO2-转化成Cl-,SO2被氧化成SO42-,因此离子反应方程式为2SO2 +C1O2-+2H2O=2SO42-+C1-+4H+;② 根据题中信息,亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,C1O2和Cl2溶于水可提高脱除率。
,代入数值,解得K=1.1×1012;(3)本题考查氧化还原方程式的书写,①因为Cl2和ClO2能与SO2发生反应,因此ClO2-转化成Cl-,SO2被氧化成SO42-,因此离子反应方程式为2SO2 +C1O2-+2H2O=2SO42-+C1-+4H+;② 根据题中信息,亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,C1O2和Cl2溶于水可提高脱除率。


科目:高中化学 来源: 题型:
【题目】常温下,若200mL c(H+)=1×10-3mol/L的某一元酸和100mL c(OH-)=1×10-3mol/L的某一元碱溶液混合后,溶液pH>7,所用的酸和碱可能是 ( )
A. 等浓度的弱酸和强碱 B. 稀的强酸和稀的强碱
C. 稀的弱酸和浓的强碱 D. 稀的强酸和浓的弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日中国大飞机C919成功首飞,象征着我国第一架真正意义上的民航干线大飞机飞上蓝天!飞机机体的主要材料为铝、镁等,还含有极少量的铜。飞机发动机的关键部位的材料是碳化钨等。回答下列问题:
(1)铜元素的焰色反应呈绿色,其中绿色光对应的辐射波长为____________(填字母)nm。
A. 404 B.543 C. 663 D. 765
(2)基态Cu原子中,核外电子占据最髙能层的符号是_______,占据该能层电子的电子云轮廓图形状为___________。钾元素和铜元素属于同一周期,且核外最外层电子构型相同,但金属钾的熔点、沸点都比金属铜低,原因是_________________________________。
(3)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料——玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图a所示。其中碳原子的杂化方式为______。


(4)图b为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙固溶体,也称为填隙化合物。在此结构中,1个钨原子周围距离钨原子最近的碳原子有__________个,该晶体的化学式为_________________。
(5)该部分晶体的体积为Vcm3,则碳化钨的密度为______________(用NA来表示阿伏伽德罗常数的值)g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中“石碱”一条记载:石碱出山东济宁诸处,彼人采篙寥之属,晒干烧灰,以水淋汁,久则凝淀如石,洗衣发面,亦去垢发面。这里的“石碱”是指
A. KOH B. KAl (SO4)2 C. KHCO3 D. K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 物质的化学反应与体系的能量变化不是同时发生的
B. 化学键可以使离子相结合,不可以使原子相结合
C. 相同温度、压强时,等体积的O2和O3含有相同数目的原子
D. 在周期表中金属与非金属分界处,可以找到半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:C(s)+CO2(g)![]() 2CO(g) △H>0在一固定的密闭容器中发生。下列说法正确的是
2CO(g) △H>0在一固定的密闭容器中发生。下列说法正确的是
A. 升高反应温度,正反应速率增加,逆反应速率下降
B. CO2的消耗速率和CO的生成速率之比为1∶2时,反应达到化学平衡状态
C. 不能用气体密度来判断反应是否达到平衡
D. 0.2mol的C和0.1mol的CO2充分反应生成的CO的物质的量一定小于0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A.19种 B.9种 C.15种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 500 ℃,30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ·mol-1
D. 已知2C(s)+2O2(g)===2CO2(g) ΔH1 ; 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com