
【题目】对于反应A(g)+3B(g)===4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是( )
A.v(A)=0.4 mol/(L·s) B.v(B)=0.8 mol/(L·s)
C.v(C)=1.2 mol/(L·s) D.v(D)=0.7 mol/(L·s)
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
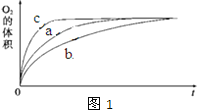
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
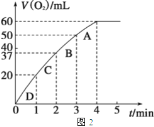
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C 均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是( )
A.离子半径:A2->C->B2+
B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性:A>C
D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
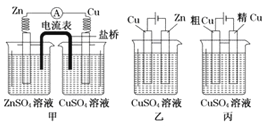
A.甲是原电池,乙是电镀装置 B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解 D.丙装置中,铜电极的质量有增有减
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液E,某学生设计如下实验方案:
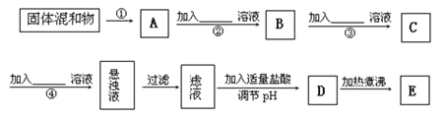
(1)操作①主要是将固体溶解,则所用的主要玻璃仪器是_____ __、____ ___。
(2)操作②~④加入的试剂依次可以为(写化学式):______________________________;
(3)如何判断SO42-已除尽?_________ ____ ___;
(4)写出加入适量盐酸调PH反应的离子方程式_____________________ ____;
(5)该同学的实验设计方案是否严密?请说明理由:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚刚从农业学院毕业的小刘,准备利用所学的知识在农村搞无土栽培。他配制的培养液中含有Mg2+、K+、Ca2+、Zn2+,其浓度都是0.1molL﹣1,培养一段时间后,培养液中剩余最多的是( )
A. Ca2+ B. Mg2+ C. K+ D. Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
【探究二】
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):
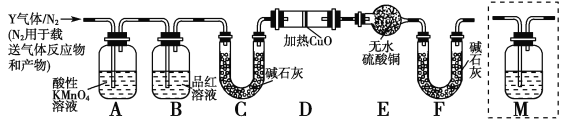
(3)装置B中试剂的作用是________。
(4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4molL-1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2 溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为_________________________.
(2)硫酸的物质的量浓度:![]() =____________________________.
=____________________________.
(3)该HCl气体在标准状况下的体积为_____________mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO310H2O晶体,直到不再产生气体时为止,消耗Na2CO310H2O晶体的质量为____________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com