
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。

燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:

①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。

(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
【答案】![]() 在温度一定时,压强越高,
在温度一定时,压强越高,![]() 含量越低 其它条件不变时,压强越小,温度对
含量越低 其它条件不变时,压强越小,温度对![]() 含量的影响越明显 降低温度,增加压强 水蒸气
含量的影响越明显 降低温度,增加压强 水蒸气 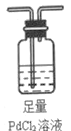
![]()
【解析】
(1)根据图1的流程图可知,气化反应器中反应物为碳和水,生成物为氢气和一氧化碳,反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据图2可知,在温度一定时,压强越高,![]() 含量越低;其它条件不变时,压强越小,温度对
含量越低;其它条件不变时,压强越小,温度对![]() 含量的影响越明显;根据图2可知,温度越低,压强越大,
含量的影响越明显;根据图2可知,温度越低,压强越大,![]() 含量越小,所以要减少
含量越小,所以要减少![]() 的排放量,可以降低温度,增加压强,故答案为:在温度一定时,压强越高,
的排放量,可以降低温度,增加压强,故答案为:在温度一定时,压强越高,![]() 含量越低;其它条件不变时,压强越小,温度对
含量越低;其它条件不变时,压强越小,温度对![]() 含量的影响越明显;降低温度,增加压强;
含量的影响越明显;降低温度,增加压强;
(3)根据图1的流程图可知,该燃烧技术中可循环的物质除![]() 、CaS外,还有水蒸气,故答案为:水蒸气;
、CaS外,还有水蒸气,故答案为:水蒸气;
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,需要用一个洗气装置,装置中装足量的
中的CO,需要用一个洗气装置,装置中装足量的![]() 溶液,装置图为
溶液,装置图为 ,故答案为:
,故答案为: ;
;
(5)Na2CO3溶液的浓度为![]() ,等体积混合后溶液中
,等体积混合后溶液中![]() ,根据
,根据![]() 可知,
可知,![]() ,原溶液
,原溶液![]() 溶液的最小浓度为混合溶液中
溶液的最小浓度为混合溶液中![]() 的2倍,故原溶液
的2倍,故原溶液![]() 溶液的最小浓度为
溶液的最小浓度为![]() ,故答案为:
,故答案为:![]() 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
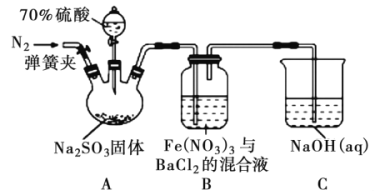
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.

1)写出该反应的方程式:__________________
2)计算该温度下该反应的平衡常数:____________
3)已知:K(300℃)<K(350℃),该反应是__________热反应.
4)0~4分钟时,B的平均反应速率为:____________
5)到达平衡时A的转化率为:____________
6)恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及其分析叙述正确的是( )
A.向2.0mL浓度均为0.lmolL-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解
C.向AlC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失
D.将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
(已知:Ksp(ZnS)=3×10﹣25mol2/L2)

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=10﹣35.4mol2/L2
D. 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,不溶于水和乙醚(易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,其制备装置如下(已知Cr3+水溶液颜色为绿色,Cr2+水溶液颜色为蓝色):

(1)装置甲中连通管a的作用是________________________。
(2)向三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液:关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速;当观察到三颈烧瓶中溶液颜色__________________时,打开k2关闭k1,当观察到装置乙中出现大量红棕色晶体时,关闭分液漏斗的旋塞。
(3)装置乙中反应的离子方程式为__________________________________。
(4)将装置乙中混合物快速过滤、洗涤和干燥,称量得到a g [Cr(CH3COO)2]2·2H2O。洗涤时依次用去氧的冷蒸馏水、无水乙醇、乙醚洗涤。其中乙醇洗涤的目的是___________。
(5)若实验所取用的CrCl3溶液中含溶质b g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376) 的产率是________________。
(6)该实验装置有一个明显的缺陷,解决此缺陷的措施为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:____________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=________,b=________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
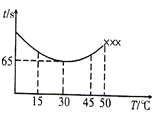
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:____。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二:_________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定):____。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )
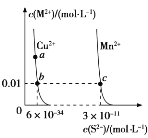
A.该温度下,Ksp(CuS)小于 Ksp(MnS)
B.a 点对应的 Ksp 等于 b 点对应的 Ksp
C.在含有 CuS 和 MnS 固体的溶液中 c(Mn2+)∶c(Cu2+)=2×10-23∶1
D.向 CuSO4 溶液中加入 MnS 发生如下反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]()
![]()
![]() 在密闭容器反应,达到平衡状态的标志是( )
在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(2)(3)(4)(5)B.(2)(3)(4)C.(1)(3)(4)(5)D.(1)(4)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com