
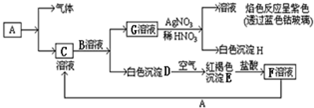


科目:高中化学 来源: 题型:
| ||
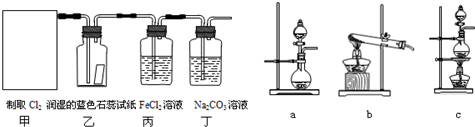
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去苯中苯酚,加入溴水后过滤 |
| B、分离苯和溴苯,加水后分液 |
| C、除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 |
| D、区别乙酸、乙醛、乙醇,加入Cu(OH)2悬浊液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀 |
| C、乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
| D、3-甲基戊烷的一氯代产物有(不考虑立体异构)4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示:
某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NH4+、SO42-、NO3- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、Al3+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、多肽、油脂、纤维素、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、棉、麻、蚕丝、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| C、蛋白质是结构复杂的高分子化合物,蛋白质分子中都含有C、H、O、N四种元素 |
| D、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
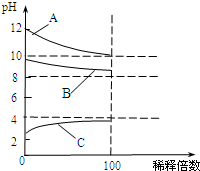 现有常温时浓度相同的五种电解质溶液:
现有常温时浓度相同的五种电解质溶液:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com