
【题目】甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答:①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答: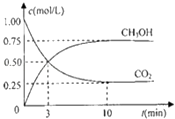
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使v(CO2)增大的是 .
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H﹣H键断裂.
【答案】
(1)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;147KJ
(2)0.225 mol?L﹣1?min﹣1;AD;AC
【解析】解:(1)①88gCO2的物质的量为n= ![]() =
= ![]() =2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol, 故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;
=2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol, 故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;
②每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,若生成3mol甲醇放出的热量为49kJ×3=147KJ,
故答案为:147KJ;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
H2的平均反应速率v(H2)= ![]() =0.225molL﹣1min﹣1 ;
=0.225molL﹣1min﹣1 ;
故答案为:0.225molL﹣1min﹣1 ;
②A.加入催化剂,v (CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物浓度不变,所以v (CO2)不变,故B错误;
C.将H2O(g)从体系中分离,则生成物浓度减小,则浓度减小,故C错误;
D.升高温度,v (CO2)增大,故D正确;
故选:AD;
③A.反应前后气体的体积不等,所以压强一直在变,则当压强不变时能说明达到平衡,故A正确;
B.反应前后质量不变,体积也不变,所以密度一直不变,则混合气体的密度不再变化不能说明达到平衡,故B错误;
C.CO2、H2和CH3OH的浓度不再变化,说明达到平衡,故C正确;
D.单位时间内消耗3molH2的同时生成1molCH3OH,都是指正反应方向,不能说明达到平衡,故D错误;
E.CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,CO2结构简式为O=C=O,1个分子有2个C=O键,当2个C=O键断裂的同时,必有3个H﹣H键断裂.与是否已达到平衡
无关,故E错误;
故选AC.
(1)①根据n= ![]() 计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
②反应热与化学计量数成正比,根据热化学方程式计算;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;
①依据化学平衡三段式列式利用V= ![]() 计算;
计算;
②依据升温,增加浓度,加压,加催化剂等可以加快反应速率判断;
③可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】根据化学常识判断下列说法正确的是( )
A. 铅笔芯是主要含有铅的笔芯 B. 加碘食盐是加有I2的食盐
C. 碘酒是含有的I2的酒精 D. 纯碱是纯净的烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是( )
A. Na2O2是碱性氧化物,可以做潜水艇中的供氧药品。
B. Fe2O3俗称铁红,可用于制作红色油漆。
C. 烧碱和小苏打都可用于治疗胃酸过多
D. 氢氧化铁胶体具有吸附性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.1molL﹣1min﹣1 , 计算:
(1)前2min内用X的浓度变化表示的平均反应速率.
(2)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质所含的杂质(括号内的物质)所选用的试剂不正确的是( )
A.乙酸(苯甲酸):NaOH溶液
B.甲烷(乙炔):溴水
C.苯(苯甲酸):NaOH溶液
D.乙炔(硫化氢):亚硫酸钠酸性溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com