
【题目】【湖南省2017年考前演练卷(三)】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 k J·mol1
2NO(g) ΔH=+180.5 k J·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 k J·mol1
2NO2(g) ΔH=116.5 k J·mol1
回答下列问题:
(1)CO的燃烧热为_________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)CO将NO2还原为单质的热化学方程式为_______。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.28 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=___________,此温度下,该反应的平衡常数K=________。
②能说明上述反应达到平衡状态的是_________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是___________ ,图中压强(p1,p2

【答案】 283KJ/mol 631.75 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol
1.875×10-4mol/(L·s) 5000(或5000L/mol) BD 该反应的正反应放热,升高温度,平衡逆向移动,NO的转化率减小(或正反应放热,温度越高,越不利于反应正向进行,NO的平衡转化率越小) p1>p2>p3
【解析】(1)由①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热为283KJ/mol。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g) 分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热为283KJ/mol。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g) 分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g)![]() 2NO(g) ΔH=946k +498k -2x=+180.5,解之得x=631.75,所以1 mol NO(g) 分子中化学键断裂时需吸收的能量为631.75kJ。
2NO(g) ΔH=946k +498k -2x=+180.5,解之得x=631.75,所以1 mol NO(g) 分子中化学键断裂时需吸收的能量为631.75kJ。
(2)由①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566.0 kJ·mol1,②N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1,②N2(g)+O2(g)![]() 2NO(g) ΔH==+180.5kJ/mol,③2NO(g)+O2(g)
2NO(g) ΔH==+180.5kJ/mol,③2NO(g)+O2(g)![]() 2NO2(g) ΔH=116.5 kJ·mol1,①
2NO2(g) ΔH=116.5 kJ·mol1,①![]() 2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(566.0 kJ·mol1)
2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(566.0 kJ·mol1)![]() -(+180.5kJ/mol)-( 116.5 k J·mol1)=-1196kJ/mol,所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol。
-(+180.5kJ/mol)-( 116.5 k J·mol1)=-1196kJ/mol,所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol。
(3)①由表中数据可知,前2 s内,NO的变化量为(10.0-2.50)![]() =7.50
=7.50![]() mol/L,由N原子守恒可得N2的变化量为3.75mol/L,所以前2 s内平均反应速率v(N2)=
mol/L,由N原子守恒可得N2的变化量为3.75mol/L,所以前2 s内平均反应速率v(N2)=![]() 1.875×10-4mol/(L·s),此温度下,反应在第4s达平衡状态 ,各组分的平衡浓度分别为c(NO)=1.00
1.875×10-4mol/(L·s),此温度下,反应在第4s达平衡状态 ,各组分的平衡浓度分别为c(NO)=1.00![]() mol/L、c(CO)=2.70
mol/L、c(CO)=2.70![]() mol/L、c(
mol/L、c(![]() )=
)=![]() =4.5
=4.5![]() mol/L、c(
mol/L、c(![]() )=
)=![]() =9
=9![]() mol/L,所以该反应的平衡常数K=
mol/L,所以该反应的平衡常数K=![]() =
=![]() =5000。
=5000。
②A.在反应过程中关系式2n(CO2)=n(N2) 恒成立,所以不能说明是平衡状态; B.虽然反应过程中气体的总质量恒不变,但是气体的总物质的量变小,所以混合气体的平均摩尔质量在反应过程中变大,相对分子质量也变大,因此当气体的琷相对分子质量不变时,能说明是平衡状态;C.反应过程中气体的总体积和总质量都不变,所以气体密度不变 ,因此该说法也不能说明是平衡状态; D.正反应是气体体积减小的反应,所以反应过程中气体的压强是变量,当容器内气体压强不变时,说明反应达平衡状态。综上所述,能说明上述反应达到平衡状态的是BD。
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是该反应的正反应放热,升高温度,平衡逆向移动,NO的转化率减小(或正反应放热,温度越高,越不利于反应正向进行,NO的平衡转化率越小);由反应方程式可知,在相同温度下压强越大,越有利于反应正向进行,则NO的转化率越大,所以图中压强(p1,p2、p3)的大小顺序为p1>p2>p3 。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,由相同种类元素组成的是
A. 胆固醇、脂肪酸、脂肪酶 B. 性激素、生长激素、胰岛素
C. 氨基酸、核苷酸、丙酮酸 D. 淀粉、半乳糖、糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
(1)实验室制取乙炔的化学方程式为___________________________。
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为___________________________。
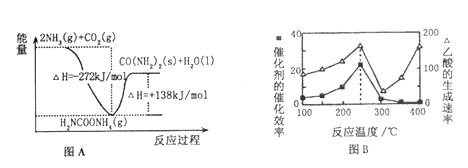
(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。250℃和400℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为_________℃。
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO![]() 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
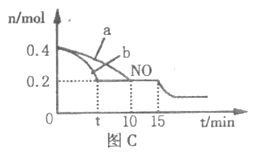
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将______(填“向左”、“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____________(任答一条即可)。
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为____________________。
②若垃圾渗滤液中氨氮物质的质量分数为0.034% ,理论上用电解法净化It该污水,电路中转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯甲酸的重结晶实验,其结论或解释错误的是
选项 | 实验步骤 | 实验现象 | 结论或解释 |
A | 常温溶解 | 苯甲酸几乎不溶 | 苯甲酸常温时不溶于水或微溶于水 |
B | 加热溶解 | 苯甲酸完全溶解 | 温度升高,苯甲酸溶解度增大 |
C | 趁热过滤 | 过滤时伴有晶体析出 | 此晶体为杂质所形成 |
D | 冷却结晶,滤出晶体 | 针状晶体 | 针状晶体为苯甲酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量均为44的有机物质A(CxHyOz)和B(CmHn),下列说法正确的是( )
A. 如果m大于x,则y可能小于n B. 可以确定物质B的分子式和结构式
C. 物质A能发生加成反应和银镜反应 D. 物质B与水加成能生成物质A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿伏加德罗常数NA,下列说法正确的是( )
A. 浓硫酸催化,1mol乙醇与1.2mol醋酸充分反应可生产NA个乙酸乙酯分子
B. 0.1mol·L-1 HCOOH 电离得到NA个H+
C. 乙醛与足量的银氨溶液反应,一共断裂2NA个共价键
D. 铜催化下有1mol 2-丙醇全部转化为丙酮,失去2NA 个e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【湖南省2017届考前模拟卷(3)】室温时,将0.10 mol·L1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示。当V(NaOH)=20.00 mL,二者恰好完全反应。则下列有关说法不正确的是

A.该一元酸溶液浓度为0.10 mol·L1
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka≈l×105
D.a点和c点所示溶液中H2O的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com