
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题。
(1)焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了________而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。请分析
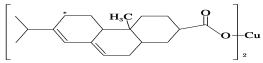
1个松脂酸铜中π键的个数为________;加“*”碳原子的杂化方式为________。
(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为________,比较第一电离能:S________O(填“>”或“<”)。
【答案】跃迁 6 sp3 折线形(V形或角形) <
【解析】
(1)基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色;
(2)单键为σ键,双键含有1个σ键、1个π键;加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3)计算S原子孤对电子、价层电子对数确定其空间结构,同主族自上而下第一电离能减小。
(1)基态Cu原子外围电子排布式为:3d104s1,基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色;
(2)1个松脂酸铜中含有个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化;
(3)S原子孤对电子数为![]() =1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O。
=1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)③、④、⑧的原子半径由大到小的顺序为:______(用元素符号回答)。
(2)⑤、⑥、⑦的最高价氧化物对应的水化物碱性由强到弱的顺序是:______。(用化学式回答)
(3)②和⑨两种元素成的某化合物是一种常见的有机溶剂,则该化合物的电子式为:______ 。
(4)④和⑧形成的化合物属于______晶体(填“离子”、“分子”、“原子”),该晶体中微粒间的作用力为:______。
(5)②形成的单质与③形成的最高价氧化物的水化物的浓溶液发生化学反应的方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量 1-溴丙烷的主要步骤如下:
步骤 1:在仪器 A 中加入搅拌磁子、12g 正丙醇及 20mL水,冰水冷却下缓慢加入 28ml浓 H2SO4;冷却至室温,搅拌下加入 24gNaBr。
(已知: ①2NaBr+H2SO4(浓)![]() Na2SO4+2HBr↑
Na2SO4+2HBr↑
②正丙醇和浓硫酸共热会产生丙烯、醚等副产品)
步骤 2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
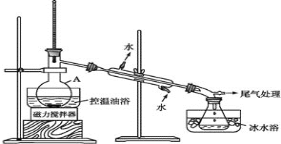
步骤 3:将馏出液转入分液漏斗,分出有机相。
步骤 4:将分出的有机相转入分液漏斗,依次用 12mLH2O、12ml5%Na2CO3 溶液和12mLH2O 洗涤,分液,得粗产品,进一步提纯得 1-溴丙烷。
(1)仪器 A 的名称是_____;
(2)反应时生成的主要有机副产物 2-溴丙烷和_______(答出一种即可给分)
(3)步骤 2 中需向接收瓶内加入少量冰水并置于冰水浴中的目的是____。
(4)步骤 1 中浓 H2SO4 用水稀释,待冷却至室温后再加 NaBr 的目的是______。步骤 4 中用 Na2CO3 溶液洗涤的目的是_____。
(5)步骤 4 中进一步提纯 1-溴丙烷的方法是_________;在进行此操作之前需要 用无水MgBr2 处理粗产品,其目的是_____。
(6)1-溴丙烷在一定条件下也可以制备 1-丙醇,请写出由产物 1-溴丙烷制备 1-丙醇的化学反应方程式________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: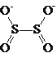 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
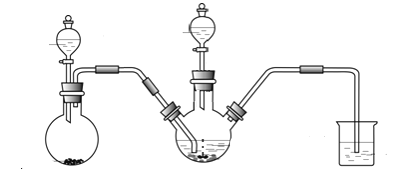
(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() ,
,![]() ,
,![]() 下
下![]() 和
和![]() 随时间变化的关系如下图所示。下列叙述正确的是( )
随时间变化的关系如下图所示。下列叙述正确的是( )
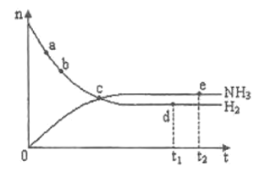
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(![]() 时刻)处
时刻)处![]() 大于点e(
大于点e(![]() 时刻)处
时刻)处![]()
D.其他条件不变,![]() 下反应至
下反应至![]() 时刻达到平衡,则此时n(H2)比上图中d点的值大
时刻达到平衡,则此时n(H2)比上图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验(夹持仪器已省略)。
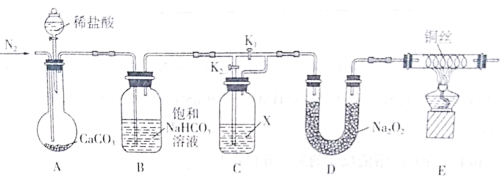
回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是________。
(2)饱和NaHCO3溶液的作用是_________;试剂X是___________。
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是_______。
(4)若_____(填操作),E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应。
(5)写出D中CO2与Na2O2反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 电子云表示电子在原子核外运动的轨迹
B. Fe3+的最外层电子排布式:3s23p63d5
C. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ:(1)将钠、铁、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:____________与盐酸反应最剧烈。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________。
Ⅱ:利用如图装置可验证同主族元素非金属性的变化规律。

(1)仪器B的名称为_____________,干燥管D的作用为防止______________________。
(2)若要证明非金属性:Cl>I-,则A中加浓盐酸,B中加KMnO4,KMnO4与浓盐酸常温下反应生成氯气,C中加淀粉-碘化钾混合溶液,观察到C中溶液__________________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(3)若要证明非金属性:![]() ,则在A中加盐酸、B中加
,则在A中加盐酸、B中加![]() 、C中加
、C中加![]() 溶液。观察到C中溶液_____________
溶液。观察到C中溶液_____________![]() 填现象
填现象![]() ,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶除去。
,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com