
| A.3/10 | B.16/3 | C.3/16 | D.5/16 |
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.69 g NO2与N2O4混合气体所含原子数介于4.5 NA至9.0 NA之间 |
| B.此反应中转移的电子数为NA |
| C.最终可收集到11.2 L无色气体 |
| D.若将所得硝酸制成浓硝酸,常温下最多可溶解0.25 mol铁。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2mol | B.3mol | C.4mol | D.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |
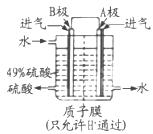


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中转移的电子总数为3nx mol |
| B.Cr2O72-转化为沉淀时被氧化 |
| C.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
| D.在FeO?FeyCrxO3中3y=x |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. mol·L-1 mol·L-1 | B. mol·L-1 mol·L-1 | C. mol·L-1 mol·L-1 | D. mol·L-1 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com