
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。

下列说法不正确的是:
A. 气体A一定是混合气体
B. 沉淀A一定是H2SiO3
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 该固体混合物一定含有Fe、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”是化学工作者研究的重要课题。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)CO2和H2充入一定体积的密闭容器中,两种温度下CH3OH的物质的量随时间的变化见图1。曲线I、Ⅱ对应的平衡常数大小关系为KⅠ____KⅡ(填“>”、“<”或“=”)。

(2)某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图2曲线(甲)所示。
①a点正反应速率_________逆反应速率(填“>”、“<”或“=”);
0-10min内v(CH3OH) =__________mol·L-1·min-1。
②若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______填序号)。
A.加催化剂 B.增大压强
C.升高温度 D.增大CO2浓度
(3)830 ℃,反应的平衡常数K=1。在2L恒容反应器中发生上述反应,按下表中A、B、C、D四组的物质的量投入反应混合物,其中向正反应方向进行的有_____(填序号)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 0 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 0 | 2 | 3 | 2 |
(4)研究发现,在相同条件下还发生另一个平行反应CO2(g)+H2(g)![]() CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
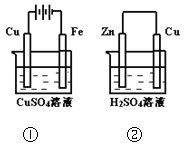
A. 在①中Cu棒为阳极;在②中Cu棒为负极
B. 电极上生成物质的质量:①<②
C. 电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑
D. 溶液的pH:①不变;②增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:![]()
![]()
则用NH3处理NO生成氮气和气态水的热化学方程式为_______________________________。
(2)已知:![]() 。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中
。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图所示。
的物质的量分数如图所示。

①M点的v正___________Q点的v正(填“>”“<”或“=”)。
②图中M点的平衡常数比N点的平衡常数___________(填“大”“小”或“相等”)
(3)水体中过量氨气(以![]() 表示)会导致水体富营养化。
表示)会导致水体富营养化。

①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式____________。
②该反应需控制温度,温度过高时氨氮去除率降低的原因是_____________________。
(4)氮氧化物也可用碱溶液吸收。若NO和![]() 混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___________;已知常温下,
混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___________;已知常温下,![]() ,则反应
,则反应![]() 的平衡常数的数值为_____________。
的平衡常数的数值为_____________。
(5)利用反应![]() (未配平)消除用电器
(未配平)消除用电器![]() 的简易装置如图所示。
的简易装置如图所示。

①a电极上的反应式为____________________________________________。
②常温下,若用该电池电解0.6L饱和食盐水,一段时间后,测得饱和食盐水pH变为13,则理论上b电极上消耗B气体的体积为___________ mL(标准状况;假设电解过程中溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中的X为阳离子交换膜。请按要求回答相关问题:
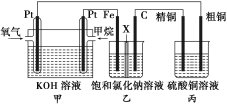
(1)甲烷燃料电池的负极反应为__________________________。
(2)石墨(C)极的电极反应为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的体积为________L。
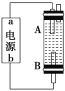
(4)某同学利用甲烷燃料电池设计电解法制取漂白液的实验装置(如图)。若用于制漂白液,a为电池的______极,电解质溶液最好用______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于小苏打水溶液的表述正确的是
A. c (Na+)=c (HCO3-) + c (CO32-) + 2c (H2CO3)
B. c (Na+) + c (H+) = c (HCO3-) + 2c (CO32-) +c (OH-)
C. HCO3- 的电离程度大于HCO3-的水解程度
D. 存在的电离有:NaHCO3=Na++HCO3—,HCO3— ![]() H++CO32—,
H++CO32—,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com