
����Ŀ����Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ����Ӧ��ǰ������ҵ��ͨ��ý���������ɵ�CO��H2�ϳɼ״�����Ӧԭ��Ϊ��CO(g)��2H2(g) ![]() CH3OH(g)
CH3OH(g)
(1)��һ�ݻ��ɱ���ܱ������г���10 mol CO��20mol H2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת����(a)���¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ1��ʾ��
�ٺϳɼ״��ķ�ӦΪ_____(����ȡ������ȡ�)��Ӧ���ж�������_________��ƽ�ⳣ��KA_____KC(�>������<����=��)��
�������йظ÷�Ӧ��˵����ȷ����_____(����ĸ���)��
A.��v(CO)����=2v����(H2) ʱ�÷�Ӧ�ﵽƽ��״̬
B.�����������䣬ֻ�ı�CO��H2��Ͷ�������÷�Ӧ���ʱ䷢���ı�
C.�ڷ�Ӧ�����л��������ܶȺ����ƽ�������������������仯
D.ʹ�ô������Լ�С��Ӧ�Ļ��
(2)���д�ʩ������״����ʵ���________��
A.ѹ���������
B.���������³���He��ʹ��ϵ��ѹǿ����
C.��CH3OH (g)����ϵ�з���
D.��ѹ�������ٳ���10mol CO��20mol H2
(3)�״�һһ����ȼ�ϵ��װ����ͼ2��ʾ��
�ٸõ�ؼ缫�ĵ缫��ӦʽΪ_________��
�����ô˼״�ȼ�ϵ�ص��200mL ����Ũ��NaCl��CuSO4�Ļ����Һ���缫Ϊ���Ե缫�������뷴Ӧ�����缫�����������������£�����ʱ��Ĺ�ϵͼ��ͼ3��ʾ������Һ������ͭ��Ũ��Ϊ______mol/L��

���𰸡� ���� ��ͼ1���Կ�������ѹǿ���������£����¶�T�����ߣ�CO ת���ʼ��ͣ�˵��ƽ�������ƶ���������Ϊ���ȷ�Ӧ > BD AC CH3OH +H2O-6e-=CO2+6H+ 0.1
��������(1)����ͼ��֪�����¶�����CO��ת���ʼ�С��˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������������Ӧ�¶�����ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������A��C�����ƽ�ⳣ��KA��KC��
��A.v(CO)������v����(H2) ��Ϊ�淴Ӧ���ʣ����ж���ƽ��״̬����A����B.�÷�Ӧ���ʱ��뷴Ӧ��������йأ���B��ȷ��C.�ڷ�Ӧ����������ͻ�����������ʼ�ղ��䣬���������������ʵ����ı䣬����������ܶȲ��䣬���ƽ�����������ı䣬��C����D.ʹ�ô������Լ�С��Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���D��ȷ����ΪBD��
(2)A.ѹ�����������ƽ�������ƶ���������״����ʣ���A��ȷ��B.���������³���He��ʹ��ϵ��ѹǿ����ƽ�ⲻ�ƶ�����������״����ʣ���B����C.��CH3OH (g)����ϵ�з��룬�ٽ�ƽ�������ƶ���������״����ʣ���C��ȷ��D.��ѹ�������ٳ���10molCO��200mol H2���൱������ƽ��״̬��ӣ�ƽ�ⲻ�ƶ����������Ӽ״��IJ���������������״����ʣ���D����ΪAC��
(3)��ȼ�ϵ�ع���ʱ����(H+)�������ƶ�����缫Ϊ�������״�����������Ӧ����缫��ӦʽΪCH3OH +H2O-6e-=CO2+6H+��
�ڽ��ͼ��֪�����200mLһ��Ũ�ȵ�NaCl��CuSO4�����Һ����������2Cl--2e-=Cl2����4OH--4e-=O2��+2H2O����������Cu2++2e-=Cu��2H++2e-=H2���������������Ȳ������壬���ߢ��ʾ������������ı仯����Ϊ�������������ʱ��Ĺ�ϵ����Ϊ�������������ʱ��Ĺ�ϵ��ͼ��֪����������Ϊ224mL����t2ʱ��������Ϊ112mL��n(O2)= ![]() =0.005mol����ת�Ƶ���Ϊ0.02mol+0.005mol��4=0.04mol�����ݵ����غ㼰Cu2++2e-=Cu��֪��n(CuSO4)=
=0.005mol����ת�Ƶ���Ϊ0.02mol+0.005mol��4=0.04mol�����ݵ����غ㼰Cu2++2e-=Cu��֪��n(CuSO4)= ![]() =0.02mol������c(CuSO4)=
=0.02mol������c(CuSO4)= ![]() =0.1mol/L��
=0.1mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�����������Һ����0.1mol/LNH3��H2O��Һ��0.1mol/LNH4Cl��Һ
(1)��Һ�ٵ�PH______7���>������<����=������д��NH3��H2O�ĵ��뷽��ʽ______________��
(2)��Һ�ڳ�________�ԣ���ᡱ��������С�����
(3)����������Һ��c(NH4+)�Ĵ�С������ȷ����________������ţ���
A��������Һ��c (NH4+)������0.lmol/L
B��������Һ��c (NH4+)��С��0.lmol/L
C.NH4Cl��Һ��c(NH4+)С��NH3��H2O��Һ��c(NH4+)
(4)����Һ�Т���μ�����Һ���У�����ҺpH=7ʱ��c(NH4+)______ c(Clһ)���>������<����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и߷��ӻ������ڿ�����ȼ��ֻ����CO2��H2O����( )
A. 𤽺��ά B. �ȶ��� C. ���コ D. ë��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ�����й�������ǧ�����������ʷ�� �С� �ǻ۹��� �����ơ�
��1�� δ�����ƻ�������ɫ��ԭ����______��
��2��ƻ����Ҳ������֬����֬�������������������_____���� дһ����
��3��Ӣ����ƻ�����˾����������Ĺ��ҡ�ƻ�������ɳ���ȸߵ�ƻ���ڹ�����ø����ĸ���ȵ������¡���һϵ�б仯���ƵõĵͶȾƣ� ���й���ø����ĸ����������_________ �� �� �� �� �� �� �� �� �� �� �� Ӧ________________![]() 2C2H5OH��2CO2��
2C2H5OH��2CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ������������в���ȷ����(����)
A. Ԫ�����ڱ��й���18�У� 16��
B. ���ڱ��е����Ϊ���塢���塢0�������
C. ����Ԫ��ȫ���Ǹ���Ԫ��
D. ���嶼���ɶ�����Ԫ�غͳ�����Ԫ�ع�ͬ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ������֮һ�������ɶ���Ӿ��ಽ��Ӧ�ϳɡ�

�й��������ֻ������˵����ȷ����
A. �����£�1mol�����ֻ����1molBr2��Ӧ
B. ����Ӳ���ʹFeCl3��Һ������ɫ��Ӧ
C. 1mol�������������3mol���������ӳɷ�Ӧ
D. �����ط�����������12��ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧʵ����ȤС��̽��ʵ�������Ʊ�Cl2�Ĺ��̣�Ϊ֤����������ˮ������HCl�ӷ�������ͬʱ֤��Cl2��ijЩ���ʣ���ͬѧ���������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش����⡣
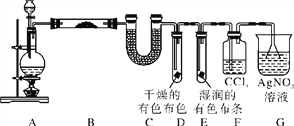
��1�����ú���0.2 mol HCl��Ũ������������MnO2��Ӧ��Cl2���Ƶõ�Cl2���(��״����)����С��1.12 L��ԭ����________________________��
��2����װ��B��ʢ�ŵ��Լ�����Ϊ_______��������___________��������___________��
��װ��D��E�г��ֵIJ�ͬ����˵����������_______________________________��
��װ��F��������____________________��
��д��װ��G�з�����Ӧ�����ӷ���ʽ��__________��
��3����ͬѧ��Ϊ��ͬѧ��ʵ����ȱ�ݣ�����ȷ������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�֤������ͨ��AgNO3��Һ������ֻ��һ�֣���ͬѧ�����ij����װ��֮���ټ�һ��װ�á�����Ϊ��װ��Ӧ����________��________֮��(��װ����ĸ���)��װ����Ӧ����________(��д�Լ�����Ʒ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4ˮ��Һ��H2C2O4��HC2O4-��C2O42-������̬�����ӵķֲ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ[��֪Ksp(CaC2O4)=2.3��10-9]������˵����ȷ����( )

A��������������������HC2O4-
B��0.1 molL-1 NaHC2O4��Һ�У�c(C2O42-)��c(H2C2O4)
C��pH=5ʱ����Һ����Ҫ��̼����Ũ�ȴ�С��ϵΪ��c(C2O42-)��c(H2C2O4)��c(HC2O4-)
D��һ���¶��£���CaC2O4������Һ�м�������CaCl2���壬c(C2O42-)����С��c(Ca2+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25Cʱ����Ũ��Ϊ0.1000 mol/L��NaOH��Һ�ζ�20. 00 mL 0 .1000 mol��L-1��
CH3COOH.���ζ�������ͼ��ʾ�����з����������

A��C�����Һ��c��CH3COOһ��+c(CH.3COOH)>c(Na+)
B��B�����Һc (CH3COOһ)>c(Na+��>c(H+��> c(OH-)
C��A���������ֵΪl
D��D����Һ2c(CH3COOH)ʮc(H+) =c(OH��)��c(CH3COO��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com