
【题目】常温下某一元碱![]() 溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是( )
溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是( )
①反应前,0.01mol/L的一元强酸HA溶液中水电离出的![]() 的浓度为
的浓度为![]()
②反应前,一元碱![]() 其溶液中溶质物质的量浓度一定大于0.01mol/L
其溶液中溶质物质的量浓度一定大于0.01mol/L
③反应后,溶液中离子浓度大小排列顺序一定是c(B+)=c(A-)>c(H+)=c(OH-)
④反应后,混合溶液中HA与A-的浓度总和等于0.01mo/L
A.①②B.①③C.②④D.①②④
【答案】B
【解析】
常温下某一元碱![]() 溶液与0.01mol/L的一元强酸
溶液与0.01mol/L的一元强酸![]() 溶液等体积混合后所得溶液的pH为7,
溶液等体积混合后所得溶液的pH为7,![]() 有可能是强碱,也有可能是弱碱,若
有可能是强碱,也有可能是弱碱,若![]() 是强碱,则
是强碱,则![]() 的浓度也为0.01mol/L,若
的浓度也为0.01mol/L,若![]() 是弱碱,则
是弱碱,则![]() 的浓度大于0.01mol/L。
的浓度大于0.01mol/L。
①反应前,0.01mol/L的一元强酸HA溶液中![]() 的浓度为
的浓度为![]() ,故溶液中的
,故溶液中的![]() 浓度为
浓度为![]() =
=![]() =1×10-12(mol/L),由水电离的
=1×10-12(mol/L),由水电离的![]() 浓度等于溶液中的
浓度等于溶液中的![]() 浓度,即水电离的H+浓度为1×10-12mol/L,故①正确;
浓度,即水电离的H+浓度为1×10-12mol/L,故①正确;
②![]() 有可能是强碱,也有可能是弱碱,若
有可能是强碱,也有可能是弱碱,若![]() 是强碱,则
是强碱,则![]() 的浓度为0.01mol/L,若
的浓度为0.01mol/L,若![]() 是弱碱,则
是弱碱,则![]() 的浓度大于0.01mol/L,故②错误;
的浓度大于0.01mol/L,故②错误;
③混合后溶液pH为7,故c(H+)=c(OH-),根据电荷守恒c(B+)+c(H+)=c(A-)+c(OH-),则c(B+)=c(A-),故离子浓度排序为:c(B+)=c(A-)>c(H+)=c(OH-),故③正确;
④HA为强酸,混合液中没有HA,且两溶液等体积混合,体积变为2倍,故浓度变为原来的一半,故④错误;
故①③正确,答案选B。


科目:高中化学 来源: 题型:
【题目】工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料。
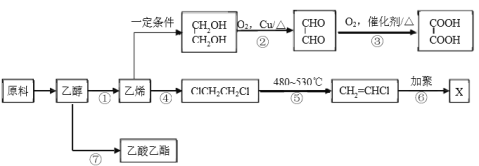
(1)反应②、③实现了官能团的转化:-OH→____________→_____________。
(2)反应④的类型是_______________。
(3)X的结构简式是____________________。
利用如图装置实现反应⑦。
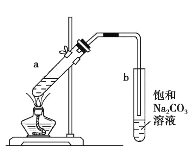
(4)⑦的化学方程式是_________________。
(5)反应结束后,振荡试管b,静置后的现象是__________________。
(6)上述装置中饱和碳酸钠溶液的作用是_______________(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列七种物质:①H2O2②Na2O2③CO2④Ne⑤MgC12⑥NaOH⑦O2。按照要求,回答下列问题:
(1)含有共价键的离子化合物有________(填序号,下同)。
(2)不含有任何化学键的物质有____________。
(3)与 Na2O中阴、阳离子个数比相等的离子化合物有__________。
(4)既含有极性键,又含有非极性键的共价化合物有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:

回答下列问题:
(1)B的分子式是___________,C中含有的官能团名称是 ____________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%,则D的结构简式为___________,⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:____________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:___________________。
i .含有苯环和![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)________________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备 的合成流程图:_______________________________________
的合成流程图:_______________________________________
合成流程图示例如下:CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
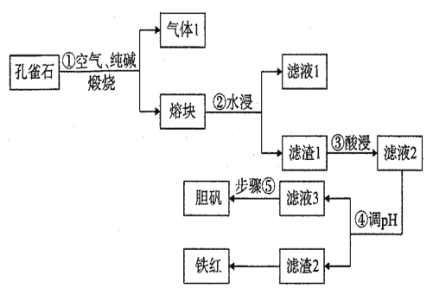
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 _______________,若反应生成1mol SO2,则反应中转移的电子数为___________mol。滤液1的主要成分为__________(写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有_________________(答出两点)。
(3)步骤④调pH所用试剂为_____________ (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=___________。
(5)步骤⑤操作为_______________________________________________________.。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:
①铁红的用途之一为________,
②孔雀石矿石中铁元素的含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是

A.可能是N2和NO2的混合气体
B.一定是NO2气体
C.一定是NO与NO2的混合气体
D.可能是NO2一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
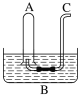
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产流程如图:

回答下列问题:
(1)装置a用磷酸吸收NH3。若该过程在实验室中进行,请画出装置a的示意图:_____。
(2)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是___________(结晶水部分不写)。
(4)利用生产磷铵排放的废渣磷石膏制取硫酸,其中SO2生产硫酸的工艺流程图如图所示:

①在A处二氧化硫被氧化成三氧化硫,设备A的名称是___________,设备A中发生反应的化学方程式是______________。为提高三氧化硫的产率,该处应采用_____(填“等温过程”或“绝热过程”)为宜。
②在D处进行二次催化处理的原因是_______________________。
③B处气体混合物主要是氮气和三氧化硫.此时气体经过C后不立即进入D是因为:___________。
④20%的发烟硫酸(SO3的质量分数为20%)1吨需加水_______吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com