
【题目】现有下列七种物质:①H2O2②Na2O2③CO2④Ne⑤MgC12⑥NaOH⑦O2。按照要求,回答下列问题:
(1)含有共价键的离子化合物有________(填序号,下同)。
(2)不含有任何化学键的物质有____________。
(3)与 Na2O中阴、阳离子个数比相等的离子化合物有__________。
(4)既含有极性键,又含有非极性键的共价化合物有_________。
【答案】②⑥ ④ ② ①
【解析】
①H2O2是既含有极性键又含有非极性键的共价化合物;
②Na2O2是既含有离子键又含有非极性共价键的离子化合物;
③CO2只含有极性共价键的共价化合物;
④Ne为稀有气体单质,为单原子分子,不含共价键;
⑤MgC12是只含有离子键的离子化合物;
⑥NaOH是既含有离子键又含有极性共价键的离子化合物;
⑦O2是只含有非极性共价键的单质;
(1)含有共价键的离子化合物有②⑥;
(2)不含有任何化学键的物质有④;
(3) Na2O为离子化合物,其中阴、阳离子个数比为1:2,Na2O2为离子化合物,由Na+和![]() 构成,则与Na2O中阴、阳离子个数比相等的离子化合物有②;
构成,则与Na2O中阴、阳离子个数比相等的离子化合物有②;
(4)既含有极性键,又含有非极性键的共价化合物有①。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置进行实验,下列有关实验操作和现象正确的是

A. 缓慢通入N2,再加热Ⅰ处的碳酸氢钠,可观察到Ⅱ处过氧化钠粉末由浅黄色变成白色
B. 缓慢通入N2,加热Ⅰ处KClO3和MnO2的混合物,可观察到Ⅱ处干燥KI淀粉试纸变成蓝色
C. 先对Ⅰ处的氯化铵加热,再缓慢通入N2,可看到Ⅰ处固体减少,Ⅱ处无固体沉积
D. 先缓慢通入CO2,再加热Ⅰ处炭粉,可观察到Ⅱ处氧化铁粉末由红色变成黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向新制氯水中逐滴滴加NaOH溶液,溶液pH随时间的变化如图所示。呈碱性时停止滴加,一段时间后溶液黄绿色逐渐褪去。由此得不到的结论是
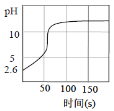
A.该新制氯水c(H+)=10-2.6mol/L
B.开始阶段,pH迅速上升说明H+被中和
C.OH-和Cl2能直接快速反应
D.NaOH和氯水反应的本质是OH-使Cl2+H2O![]() H++Cl-+HClO平衡右移
H++Cl-+HClO平衡右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )

A. 反应开始4 min内温度对反应速率的影响比浓度大
B. 一段时间后,反应速率减小的原因是c(H+)减小
C. 反应在2~4 min内平均反应速率最大
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
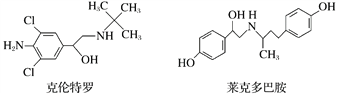
A.克伦特罗分子的分子式为C12H18ON2Cl2
B.克伦特罗能发生加成、氧化、消去等反应
C.克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D.莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下某一元碱![]() 溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是( )
溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是( )
①反应前,0.01mol/L的一元强酸HA溶液中水电离出的![]() 的浓度为
的浓度为![]()
②反应前,一元碱![]() 其溶液中溶质物质的量浓度一定大于0.01mol/L
其溶液中溶质物质的量浓度一定大于0.01mol/L
③反应后,溶液中离子浓度大小排列顺序一定是c(B+)=c(A-)>c(H+)=c(OH-)
④反应后,混合溶液中HA与A-的浓度总和等于0.01mo/L
A.①②B.①③C.②④D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,回答下列问题:
I.一定温度下,在容积为2L的恒容密闭容器中进行反应:aM(g)bN(g),M、N的物质的量随时间的变化曲线如下图所示:
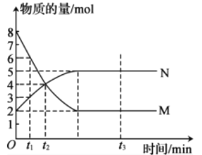
(1)此反应的化学方程式中,已知化学计量数之比为最简整数比,则b=________。
(2)若t2—t1=10min,则从t1到t2时刻,平均反应速率v(N)=________。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
II.一种新型催化剂用于 NO 和 CO 的反应:2NO+2CO2CO2 +N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验序号 | t(℃) | NO 初始浓度(mo1L-1) | CO初始浓度 (mo1L-1) | 催化剂的比表面积 (m2 g-1) |
I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
II | 280 | 1.20×10-3 | b | 124 |
III | 350 | a | 5.80×10-3 | 82 |
(1)表中,a=______,b=______。
(2)能验证温度对化学反应速率的影响规律的实验是________(填实验序号)。
(3)实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的曲线是___________(填“甲”或“乙”)。
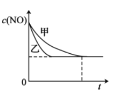
(4)若在容积固定的绝热容器中发生反应2NO+2CO2CO2 +N2,则不能说明该反应已达到平衡状态的是_________(填标号)。
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变 C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com