
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
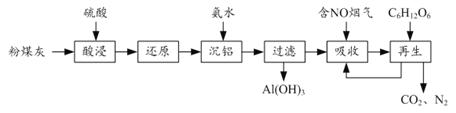
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
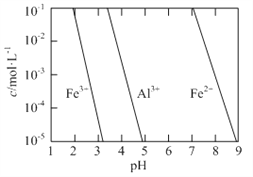
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
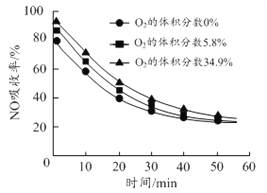
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。
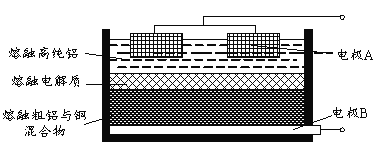
①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是

A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO![]() =PbSO4
=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,下列说法错误的是
6Cu+SO2↑,下列说法错误的是
A. 在Cu2O、Cu2S中Cu元素化合价都是+1价 B. 反应中Cu元素被氧化,S元素被还原
C. Cu2S在反应中既是氧化剂,又是还原剂 D. 每生成6.4gCu,反应中转移0.1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以下物质中:①酒精 ②熔化的KNO3 ③CaCO3 ④氢氧化钠溶液 ⑤铜 ⑥SO2
其中属于电解质的是_________(填编号,下同),属于非电解质的是__________。
(2)画出氟离子的结构示意图________________;用于制造光导纤维的物质的化学式_______。
(3)已知加热条件下氯气和NaOH溶液可发生以下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O
a.标出上面反应电子转移的方向和数目_______。
b.以上反应中氧化剂与还原剂的物质的量之比为_________。
c.若有21.3g Cl2参加反应,转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,易发生PCl5(s)![]() PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 相同条件下,起始时向容器中充入2.0 mol PCl5,PCl5的分解率增大
B. 只升高温度,平衡时c(PCl5)=0.12 mol/L,则正反应是放热反应
C. 反应在前50 s的平均速率v(PCl3)=0.0032 mol/(L·s)
D. 在密闭低温的条件下,有利于PCl5固体的保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
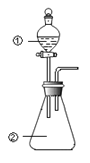
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体各个系统特别是神经系统发育所不可缺少的微量元素。海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。某课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬独液,然后按以下实验流程提取单质碘:

(1)灼烧海带时需要用到的实验仪器是___________(填标号)。
A.烧杯 B.蒸发皿 C.坩埚 D.三脚架 E.酒精灯 F.泥三角 G.玻璃棒
(2)图中操作①名称为______,操作③名称为__________。
(3)操作③中所用的有机试剂可以是_________(只填一种),理由是________。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.拧开漏斗下面的活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层液体;
G.将分液漏斗上口的玻璃塞打开(或使塞上的凹槽与漏斗上口的小孔对准);
H.静置、分层。
过程③正确操作步骤的顺序是:________(填标号);上述G步操作的目的是:_______。
(5)检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏。观察下图所示实验装置,指出需要改正的地方:_________。

上述蒸馏操作结束后,晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com