
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用元素符号、离子符号或化学式回答下列问题: 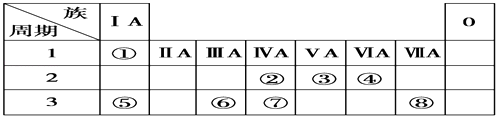
(1)④、⑥、⑧的原子半径由大到小的顺序是:(请用>、<表示) .
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是: .
(3)请写出由②、④、⑦三种元素的氢化物稳定性由弱到强的顺序是: .
(4)⑤、⑥两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是: .
(5)由表中两种元素的原子按1:1组成的一种常见液态化合物的稀溶液易被 催化分解,可使用的催化剂为(填序号) .
a.KMnO4b.MnO2c.Na2SO3 .
【答案】
(1)r(Al)>r(o)>r(Cl)
(2)HClO4>HNO3>H2CO3
(3)SiH4<CH4<H2O
(4)Al(OH)3+OH﹣=[Al(OH)4]﹣
(5)b
【解析】解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,(1)Cl与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Al>Cl,原子核外电子层数越多,半径越大,则有原子半径Al>Cl>O, 所以答案是:r(Al)>r(o)>r(Cl);(2)②、③、⑧对应的元素分别为C、N、Cl,非金属性:Cl>N>C,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HClO4>HNO3>H2CO3 ,
所以答案是:HClO4>HNO3>H2CO3;(3)②、④、⑦三种元素的非金属性O>C>Si,非金属性越强氢化物越稳定,所以三种元素的氢化物由弱到强的顺序是SiH4<CH4<H2O,所以答案是:SiH4<CH4<H2O;(4)⑤、⑥两种元素的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水;反应离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.(5)两种元素的原子按1:1组成的常见液态化合物为H2O2 , 在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
所以答案是:b.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述中不正确的是
A. 氯气呈液态时称为液氯 B. 氯气的密度比空气大
C. 氯气的水溶液含有多种分子 D. 氯气在碱性溶液中漂白性会增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);

④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
(1)实验步骤③中的溶液体积读数为________mL。
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:①________、③________。
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂________。(填“是”或“否”)
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为________。(列出算式即可)如果步骤③中读数时俯视,则最终结果________。(填“偏大”、“不变”或“偏小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述中正确的是
A. 将水沿着玻璃棒慢慢地注入盛有浓硫酸的量筒中稀释,并不断搅拌
B. 运输时可以将浓硫酸密封装在铁罐中
C. 浓硫酸滴到硫酸铜晶体中的现象体现了浓硫酸的脱水性
D. 少量浓硫酸滴入紫色石蕊溶液中,溶液会褪为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H22NH3 , 2min后测得N2的物质的量为0.6mol,则:
(1)2min内,N2的物质的量减少了0.4mol,H2的物质的量减少了mol,NH3的物质量增加了mol.
(2)若用N2的浓度变化来表示该反应的反应速率,则v(N2)=mol/(Lmin).
(3)若用H2的浓度变化来表示该反应的反应速率,则v(H2)=mol/(Lmin).
(4)若用NH3的浓度变化来表示该反应的反应速率,则v(NH3)=mol/(Lmin).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制法合理的是
A. 玻璃是纯碱和石灰石高温反应制得
B. 高炉炼铁中通过焦炭直接还原赤铁矿
C. 工业上通过电解NaCl溶液获取Na单质
D. 高纯硅的制备是通过氢气还原四氯化硅实现的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com