
【题目】(1)写出一氯甲烷的电子式____,乙烯的结构式____;
(2)乙醇催化氧化的方程式:____;
(3)写出苯和液溴在催化剂作用下生成溴苯的化学方程式___。
科目:高中化学 来源: 题型:
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是
A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2分子存在
C.加入盐酸酸化,再加入硝酸银溶液,产生白色沉淀,说明氯水中有Cl﹣存在
D.氯水放置数天后酸性将减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1 molL﹣1.某同学进行了如下实验:下列说法正确的是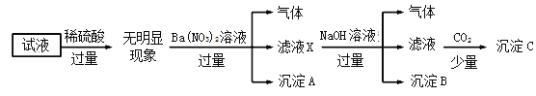
A.无法确定原试液中是否含有SO42﹣
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.沉淀C为Al(OH)3
D.原试液中一定不含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构![]() (其中Ⅰ、Ⅱ为未知部分的结构)。下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构)。下列是X发生反应的转化关系图及E的信息.
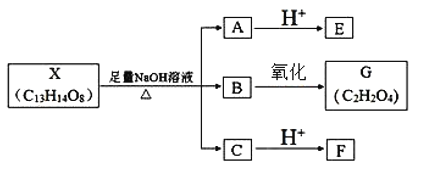
E的组成或结构信息:
①分子中含18O及苯环结构
②磁共振氢谱有4个峰,峰面积之比是1:1:2:2
③与NaHCO3溶液反应产生CO2
回答下列问题:
(1)E中含氧官能团的名称为_____________。
(2)B与G反应可生成高分子化合物M,其化学方程式是______________。
(3)X的结构简式是________________________。
(4)已知E的同系物H的相对原子质量比E多14。H的同分异构体中,满足下列条件的共有______种(不考虑立体异构)。
①能与氯化铁溶液发生显色发应;②能发生水解反应;③能发生银镜反应。
其中核磁共振氢谱为5组峰,且峰面积比为1︰1︰2︰2︰2的为____________(写结构简式)。
(5)F可作为食品饮料的添加剂,它的聚合物可作为手术缝合线等材料.
![]()
由B经过下列途径可合成F(部分反应条件略):
![]()
N→R的反应类型是________;R→T的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序___(填序号)。
(2)25℃时,体积相同,浓度均为0.2mol·L-1的氨水和NaOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为___;常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为___;
(3)用离子方程式解释碳酸钠溶液呈碱性的原因:___。
(4)能证明CH3COOH是弱酸的事实是___。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、b均能与稀硫酸反应放出气体;②c与d的硝酸盐溶液反应,置换出单质d;③b与强碱反应放出气体;④b、e在冷的浓硫酸中钝化。由此可判断a、b、c、d、e依次是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、I2固体易升华
夹持装置未画出、I2固体易升华![]() 的说法正确的是( )
的说法正确的是( )

A.加热时,①中封管内固体消失
B.加热时,②中溶液变为无色,冷却后又变红
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.加热又冷却的过程中,①④属于物理变化,②③属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com