
【题目】下列示意图与对应的反应情况正确的是
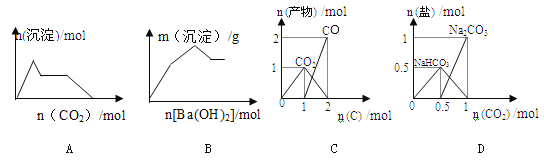
A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
C.n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
【答案】C
【解析】
A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2时,CO2先与Ca(OH)2反应:CO2+Ca(OH)2=CaCO3↓+H2O,当消耗0.01molCO2时沉淀量达最大,继续通入CO2发生反应CO2+KOH=KHCO3,此过程中沉淀量保持不变,继续通入CO2发生反应CO2+CaCO3+H2O=Ca(HCO3)2,沉淀开始溶解最终完全溶解,故A错误;
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,首先发生反应2KAl(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+K2SO4,当Al3+完全沉淀后继续通入Ba(OH)2,发生反应2Al(OH)3+K2SO4+Ba(OH)2=BaSO4+2KAlO2+4H2O,BaSO4的摩尔质量为233g/mol,Al(OH)3的摩尔质量为78g/mol,1mol硫酸钡的质量大于2mol氢氧化铝的质量,故沉淀的质量逐渐增大,直到SO42-完全沉淀,最后保持不变,B错误;
C.n(O2)=1mol,当n(C)=1mol时,反应生成1molCO2,当n(C)=2mol时,反应生成2molCO,C正确;
D.n(NaOH)=1mol,当n(CO2)=0.5mol时,产物是0.5molNa2CO3,当n(CO2)=1mol时,反应生成1molNaHCO3,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:

已知:I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
请回答下列问题:
(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是
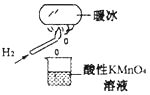
A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A在催化剂作用下加压、加热与水反应制得B,B在一定条件下氧化可得C,C在催化剂作用下与氧气反应可得D,D和B与浓硫酸混合加热可得到有香味的无色油状液体E。它们的转化关系如下:

请回答下列问题:
(1)推断下列物质: A_________,B __________,C __________,D__________,E_________; (写结构简式)
(2)写出下列反应方程式并指出反应类型。
①A→B:___________________________________________;属_________反应;
②D+B→E:___________________________________________;属_________反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
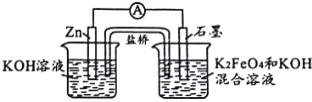
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为:Zn—2e-+2H2O=Zn(OH)2+2H+
C.充电时,阴极区溶液的pH减小
D.充电时,阳极上的电极反应式为:Fe(OH)3—3e-+5OH-=FeO4 2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%,单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示:

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是__________,与常规的萃取相比,采用索氏提取器的优点是_____。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收________。
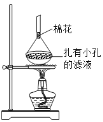
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+![]() O2(g)= CO2(g) H=-283.0 kJ/mol
O2(g)= CO2(g) H=-283.0 kJ/mol
S(g)+O2(g)=SO2(g) H=-296.0 kJ/mol
下列说法不正确的是
A.放热反应不一定是自发反应
B.CO2与SO2可以用澄清石灰水鉴别
C.CO2分子中各原子最外层均为8电子稳定结构
D.相同条件下:2CO(g)+SO2(g)=S(g)+2CO2 (g) H=-270kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___。

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com