
【题目】研究氮及其化合物的性质具有极为重要的意义。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________
(2)在含Cu+离子的酶的活化中,亚硝酸根 (NO2-)离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式 。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① NO2的体积为____________L。
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为____________molL-1。
【答案】(1)3NO2+H2O===2HNO3+NO
(2)Cu++NO2-+2H+=Cu2++NO↑+H2O
(3) 3.36 11.3
【解析】
试题分析:(1) NO2和水反应转化为HNO3的化学方程式:3NO2+H2O===2HNO3+NO
(2) Cu+和亚硝酸根离子在酸性水溶液中反应,亚硝酸根 (NO2-)离子可转化为NO,Cu+被氧化为铜离子,离子方程式Cu++NO2-+2H+=Cu2++NO↑+H2O。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① 设NO的物质的量是x mol、NO2的物质的量是y mol;根据元素守恒![]() ,根据电子守恒
,根据电子守恒![]() ,解得x=0.35、y=0.15,NO2的体积为3.36L。
,解得x=0.35、y=0.15,NO2的体积为3.36L。
②表现酸性的硝酸![]() mol,表现氧化性的硝酸
mol,表现氧化性的硝酸![]() mol,原硝酸溶液的浓度为
mol,原硝酸溶液的浓度为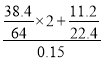 =11.3molL-1。
=11.3molL-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列变化或数据与氢键无关的是( )
A. 水的沸点比硫化氢的沸点高
B. 氨分子与水分子形成一水合氨
C. 乙醇能跟水以任意比混溶
D. SbH3的沸点比PH3高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的解释正确的是
选项 | 实验事实 | 解释 |
A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子,且苯与水互不相溶 |
D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖的结构简式为:CH2OH—CHOH—CHOH—CHOH—CHOH—CHO其对应的性质中不正确的是( )
A.1mol葡萄糖最多可以与5mol金属钠反应放出氢气
B.1mol葡萄糖最多可以与5mol乙酸发生取代反应
C.能发生银镜反应
D.可与小苏打溶液反应冒出气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺制得无 色晶体乙酰苯胺(具有退热镇痛作用的药物)。
①化学反应原理为:
![]()
②相关物质的物理常数
物质 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | ||||
苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |
③制备乙酰苯胺的装置及过程如下图所示:
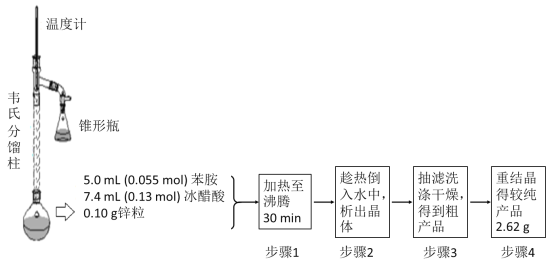
已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是___________;韦氏分馏柱作用的是_________;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是_____________;
(3)步骤2中将反应液倒入水中的目的是___________;
(4)步骤3中洗涤剂最好选择______________;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→________→__________→抽滤→洗涤→干燥;
(6)上述制备过程的产率是____________。(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是: ,非金属性最强的是 (填具体元素符号,下同)。
(2)元素⑤的氢氧化物与盐酸反应的离子方程式_____ ____。
(3)用电子式表示元素④与⑦的化合物的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铜、硝酸银溶液和银组成的原电池装置中,当导线中有0.02mol电子通过时,理论上银片的质量变化了多少?
(2)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) =xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5。求:(1)x的值和反应开始前放入容器中A、B的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:
方法一 固体氢氧化钙与氯化铵共热
方法二 固体氢氧化钠与浓氨水反应
①下面的制取装置图中,方法一应选用装置________(填“A”或“B”,下同),方法二应选用装置________。
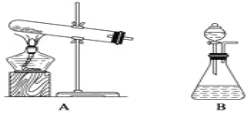
②写出加热NH4Cl和Ca(OH)2制取NH3的反应方程式:
________________________________________________________________________。
③在制取后,如果要干燥氨气,应选用的干燥剂是________,收集氨气的方法是
A.浓硫酸
B.碱石灰
C.五氧化二磷
D.向上排空气法
E.排水法
F.向下排空气法
④检验是否收集满氨气的方法是____________________________________
(2)请观察如图装置,回答下列问题:
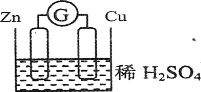
①负极是 ,发生 反应(填氧化或还原)
②正极的电极反应式:
③该装置是一种把 的装置,当导线中有0.2 mol e-发生转移时,求参加氧化反应的物质的物质的量为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com