
【题目】下表中对于相关物质的分类全部正确的是
选项 | 纯净物 | 混合物 | 非电解质 | 弱电解质 | 碱性氧化物 |
A. | 液氨 | 氢氧化铁胶体 | CO | 氢硫酸 | Al2O3 |
B. | 明矾 | 漂白粉 | 乙醇 | 硫酸钡 | Na2O |
C. | 碱石灰 | 碘酒 | Cl2 | HClO | K2O |
D. | 磁性氧化铁 | 水玻璃 | SO2 | 冰醋酸 | CaO |
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A. 蒸馏 B. 萃取 C. 升华 D. 结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图错误的是
A | B | C | D |
将二氧化硫通入到一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取某固体样品,进行如下实验:
① 取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
② 取少量滤液,加入BaC12溶液,有白色沉淀产生;
③ 取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是
A. K2SO4、 Ba(OH)2、 Na2CO3 B. K2CO3、NaCl、Ba(NO3)2
C. Na2CO3、 AgNO3、 KNO3 D. KNO3、MgCl2、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
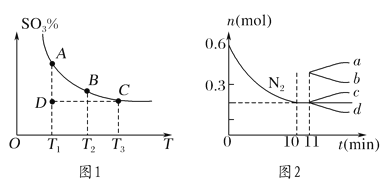
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作的原理或对应的离子方程式不正确的是
A. Mg(HCO3)2溶液中加入足量的Ba(OH)2:Mg2++2HCO3-+2Ba2++4OH-===Mg(OH)2↓+2BaCO3↓+2H2O
B. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+===SO2↑+S↓+H2O
C. K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变为黄色证明溶液中存在平衡:Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
D. 用浓盐酸酸化的KMnO4溶液与H2O2混合来证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列大小关系正确的是( )
A. 晶格能:NaCl<NaBr B. 硬度:MgO>CaO C. 熔点:NaI>NaBr D. 熔沸点:CO2>NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:
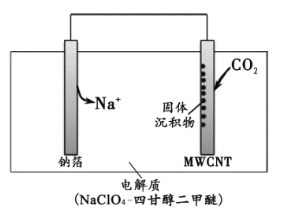
A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e—= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com