
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2) /mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3) /mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)反应速率最快的时间段是__________
A.0min-5min B .5min-10min C.10min-15min D. 15min-20min
(2)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,则此时v正 __________v逆 (填 “>”“<”或“=”)。
(3)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
(4)以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
①氨燃料电池使用的电解质溶液是4mol·L-1的KOH溶液,电池反应为: 4NH3+3O2=2N2+6H2O。该反应每消耗3.4g NH3转移的电子数目为__________;
②氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,然后向所得溶液中加入19.6gCu(OH)2固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为__________L。

【答案】 A > 80% 0.2mol/L 0.6NA 8.96
【解析】(1). 由表中数据可知,用H2表示各时间段的平均反应速率分别为:0min-5min时v(H2)=(6-4.5)mol÷1L÷5min=0.3mol/(L·min),5min-10min时v(H2)=(4.5-3.6)mol÷1L÷5min=0.18mol/(L·min),10min-15min时v(H2)=(3.6-3.3)mol÷1L÷5min=0.06mol/(L·min),15min-20min时v(H2)=(3.3-3.03)mol÷1L÷5min=0.054mol/(L·min),反应速率最快的时间段是0min-5min,故答案为:A;
(2). 773K时,将2molN2和6molH2充入一个固定容积为1L的密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g),根据平衡三段式法有:
2NH3(g),根据平衡三段式法有:
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L): 2 6 0
转化浓度(mol/L): 1 3 2
平衡浓度(mol/L): 1 3 2
平衡常数K=![]() =
=![]() =0.15,该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,Qc=
=0.15,该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,Qc=![]() =
=![]() =0.11<K,则反应正向进行,此时v正>v逆,故答案为:>;
=0.11<K,则反应正向进行,此时v正>v逆,故答案为:>;
(3). 由反应2NH3(g)+CO2(g)![]() NH2COONH4(s)△H=-160kJ/mol可知,2mol NH3完全反应时放出热量160kJ,平衡时放出128kJ的热量,则参加反应的NH3的物质的量为:n(NH3)=
NH2COONH4(s)△H=-160kJ/mol可知,2mol NH3完全反应时放出热量160kJ,平衡时放出128kJ的热量,则参加反应的NH3的物质的量为:n(NH3)=![]() mol=1.6mol,NH3的转化率为:
mol=1.6mol,NH3的转化率为:![]() ×100%=80%,该反应达到平衡时NH3和CO2的浓度分别为:0.2mol/L、0.1mol/L,则平衡常数K=
×100%=80%,该反应达到平衡时NH3和CO2的浓度分别为:0.2mol/L、0.1mol/L,则平衡常数K=![]() =250,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,根据平衡三段式法有:
=250,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,根据平衡三段式法有:
2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)
起始浓度(mol/L): 1.4 0.7
转化浓度(mol/L): 2x x
平衡浓度(mol/L): 1.4-2x 0.7-x
则K=250=![]() ,解得x=0.6mol/L,则平衡时c(NH3)=1.4mol/L-2×0.6mol/L=0.2mol/L,故答案为:80%;0.2mol/L;
,解得x=0.6mol/L,则平衡时c(NH3)=1.4mol/L-2×0.6mol/L=0.2mol/L,故答案为:80%;0.2mol/L;
(4). ①. 3.4g NH3的物质的量为3.4g÷17g/mol=0.2mol,在反应4NH3+3O2=2N2+6H2O中,N元素的化合价从-3价升高到0价,每消耗1mol氨气时转移3mol电子,则该反应每消耗3.4g NH3转移电子的物质的量为0.2mol×3=0.6mol,数目为0.6NA,故答案为:0.6NA;
②. 用氨燃料电池电解CuSO4溶液,通电一段时间后,向所得溶液中加入19.6gCu(OH)2固体后恰好可使溶液恢复到电解前的浓度,说明电解生成的物质有Cu、H2和O2,19.6gCu(OH)2的物质的量为:19.6g÷98g/mol=0.2mol,氢原子和氧原子的物质的量为n(H)= n(O)=0.2mol×2=0.4mol,根据原子守恒得:n(H


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2 (含有较多的MnO 和MnCO3) 样品转化为纯MnO2的实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:___________________________________。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、______、______、______,己知蒸发得到的固体中有NaClO3 和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2 (标准状况下),则在第②步反应中至少需要___molNaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.次外层电子数是2或8或18的原子一定是主族元素
B.短周期元素中最外层电子数等于电子层数的元素有2种
C.核外电子排布相同的微粒,一定具有相同的化学性质
D.L层上的电子数为奇数的原子一定是主族元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
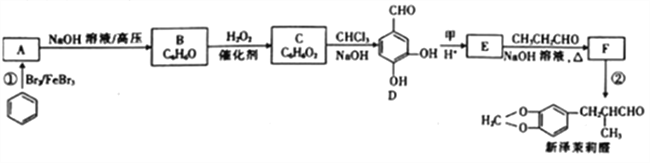
已知:①RCHO+R'CH2CHO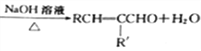
②
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备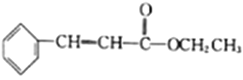 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于加成反应的是
A.乙烯通入酸性高锰酸钾溶液中B.光照射甲烷与氯气的混合气体
C.葡萄糖与银氨溶液反应D.液态植物油与氢气反应生成人造脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为_________
(2)③的反应试剂和反应条件分别是________,该反应的类型是________。
(3)⑤的反应方程式为_____吡啶是一种有机碱,其作用是______。
(4)G的分子式为___________
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com