
【题目】在一定温度下,把1molN2和3molH2通入一个一定容积的密闭的容器里,发生如下反应:N2+3H2![]() 2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=__________。
(2)若a=0.5,则b=__________和c=__________。
(3)a、b、c取值必须满足的一般条件是:请用两个方程式表示,其中一个只含a和c,另一个只含b和c______。
【答案】2 1.5 1 ![]() ;
;![]()
【解析】
给据题给信息,本题为恒温恒容条件下等效平衡的判断和计算。首先分析可逆反应,可知该反应为反应前后气体分子数不等的可逆反应。对于这样的可逆反应,要保证反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同,即要与原平衡等效,则投入的物质的量换算成同一边物质,应与之前相应物质的投入量相等。据此进行计算判断。
(1)根据反应方程式,将1molN2和3molH2换算成NH3的量,为2mol,则可知2molNH3相当于1molN2和3molH2,则c=2,答案为:2;
(2)根据反应方程式,有:
N2+3H2![]() 2NH3
2NH3
![]()
根据等效平衡有: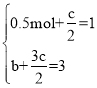 ,解得:
,解得:![]() ,答案为:1.5;1;
,答案为:1.5;1;
(3)根据题意有:
N2+3H2![]() 2NH3
2NH3
![]()
根据等效平衡有: ,答案为:
,答案为:![]() ;
;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为____;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO____(填“>”“<”或“=”)FeO。
(2)氨硼烷化合物(![]() )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
(3)![]() 俗称摩尔盐,相对于
俗称摩尔盐,相对于![]() 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:![]() 。每个晶胞含有___个钕原子,设阿伏加德罗常数为
。每个晶胞含有___个钕原子,设阿伏加德罗常数为![]() ,则金属钕的密度为___
,则金属钕的密度为___![]() (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。
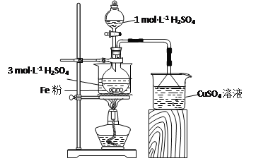
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为___。
(2)药品用量
将2gFe粉、10mL3mol·L-1H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是___。
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。为避免在上述过程中析出FeSO4晶体,可采取的措施有__。
(4)制备(NH4)2Fe(SO4)2·6H2O
①向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为___。
②为防止Fe2+被氧化,可采取的主要措施有__(填字母)。
a.(NH4)2SO4固体不配成溶液,直接加入到FeSO4溶液中
b.混合液不蒸发浓缩,直接倒入无水乙醇中析出晶体
c.析出的晶体不用水洗,用90%的乙醇溶液洗涤
d.将实验中所用的乙醇回收,蒸馏后重复使用
(5)产品检验
请补充完整测定产品中SO42-含量的实验方案:准确称取约0.4g样品,溶于70mL水,__,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中须使用的试剂有:2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.Ba(NO3)2可用于生产烟花。某主要生产 BaCl2、BaCO3、BaSO4 的化工厂利用某种钡泥[主要含有 BaCO3、Ba(FeO2)2、极少量 CuCO3 等]制取 Ba(NO3)2 晶体,其部分工艺流程如下:
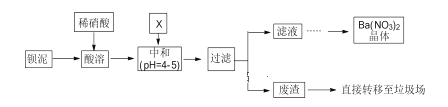
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的 pH 分别为 3.2 和 9.7。
(1)酸溶时通常不使用浓硝酸的原因是__________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2 与HNO3 的反应化学方程式为____________。
(3)该厂结合本厂实际,中和选用的 X 为__________(填化学式);中和使溶液中__________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到 Ba(NO3)2 晶体的操作依次为_____、过滤。
(5)该厂生产的 Ba(NO3)2 晶体含有少量 Cu2+ ,可通过洗涤的方法除去。证明晶体已经洗涤干净的操作方法是_______________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为___________; 为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
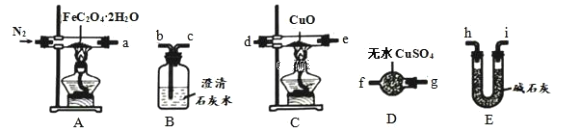
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①按照气流从左到右的方向,上述装置的接口顺序为 a→g→f→___________→尾气处理装置(仪器可重复使用)。
②实验前先通入一段时间 N2,其目的为__________。
③实验证明了气体产物中含有 CO,依据的实验现象为__________。
(2)小组成员设计实验证明了 A 中分解后的固体成分为 FeO,则草酸亚铁晶体分解的化学方程式为__________。
(3)晒制蓝图时,以 K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为__________。
Ⅱ.草酸亚铁晶体样品纯度的测定:工业制得的草酸亚铁晶体中常含有 FeSO4 杂质,测定其纯度的步骤如下:
步骤 1:称取 mg 草酸亚铁晶体样品并溶于稀 HSO4 中,配成 250mL 溶液;
步骤 2:取上述溶液 25.00mL,用 cmol/L KMnO4 标准液滴定至终点,消耗标准液 V1mL;
步骤 3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 H2SO4,再用 cmol/L KMnO4 标准溶液滴定至终点,消耗标准液 V2mL。
(4)步骤 2 中滴定终点的现象为__________;步骤 3 中加入锌粉的目的为__________。
(5)草酸亚铁晶体样品的纯度为__________;若步骤 1配制溶液时部分Fe2+被氧化变质,则测定结果将__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和烯烃混合气体的密度是 1.07g/L(标况),该烷烃和烯烃的体积比是 4:1,则这两种烃是( )
A.CH4、C4H8B.CH4、C3H6C.C2H6、C2H4D.CH4、C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com