
【题目】某溶液中大量存在以下五种离子:![]() 、M,其物质的量浓度之比为
、M,其物质的量浓度之比为![]() =2:3:1:3:1,则M可能是
=2:3:1:3:1,则M可能是
A.Ba2+B.Na+C.I-D.Mg2+
【答案】D
【解析】
其物质的量浓度之比为![]() =2:3:1:3:1,溶液的体积相等,则物质的量之比为n(NO3):n(SO42):n(Fe3+):n(H+):n(M)=2:3:1:3:1,设各离子的物质的量分别为2mol、3mol、1mol、3mol、1mol,则阴离子所带电荷n(NO3)+2×n(SO42)=2mol+2×3mol=8mol,阳离子所带电荷3×n(Fe3+)+n(H+)=3×1mol+3mol=6mol,阴离子所带电荷大于阳离子所带电荷,则M一定为阳离子,因M的物质的量为1mol,根据电荷守恒,则离子应带2个正电荷,又因Ba2+与SO42反应生成沉淀而不能大量共存,则D符合,
=2:3:1:3:1,溶液的体积相等,则物质的量之比为n(NO3):n(SO42):n(Fe3+):n(H+):n(M)=2:3:1:3:1,设各离子的物质的量分别为2mol、3mol、1mol、3mol、1mol,则阴离子所带电荷n(NO3)+2×n(SO42)=2mol+2×3mol=8mol,阳离子所带电荷3×n(Fe3+)+n(H+)=3×1mol+3mol=6mol,阴离子所带电荷大于阳离子所带电荷,则M一定为阳离子,因M的物质的量为1mol,根据电荷守恒,则离子应带2个正电荷,又因Ba2+与SO42反应生成沉淀而不能大量共存,则D符合,
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)![]() 世纪
世纪![]() 年代,
年代,![]() 和
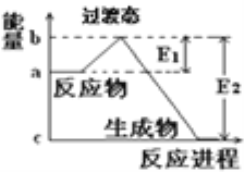
和![]() 在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是
在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,
过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,![]() 和
和![]() 的总能量________(填“
的总能量________(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)![]() 和
和![]() 的总能量.
的总能量.
(2)在某体积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]()
![]() ,
,![]() 时,测得容器中
时,测得容器中![]() 的物质的量为
的物质的量为![]() ,则:
,则:
①该段时间内,用![]() 表示的平均反应速率为________.
表示的平均反应速率为________.
②假设此反应在![]() 时达到平衡,则此时容器内气体的总物质的量为________.
时达到平衡,则此时容器内气体的总物质的量为________.
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是________
A.容器内气体的质量保持变
B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.NO2的消耗速率与![]() 的消耗速率相等
的消耗速率相等
E.容器内气体的物质的量保持不变.
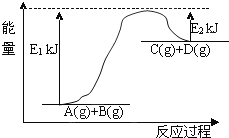
(3)已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
该反应是________反应,该反应的△H=________,1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
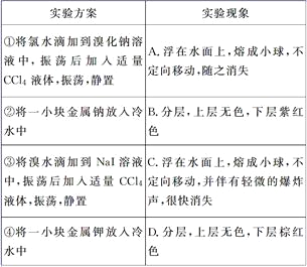
请你帮助该同学整理并完成实验报告。
(1)实验目的:_____________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳等;
②仪器:________、________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):________

(4)实验结论:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B、C.D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味,B与E的实验式相同。
![]()
根据以上信息及各物质的转化关系完成下列各题:
(1)B的化学式为____________, C中所含官能团名称__________, 与B同分异构体的一种物质的名称_____________。
(2)其中能与新制氢氧化铜悬浊液在加热煮沸条件下能产生砖红色的沉定的物质有_______(填名称)
(3)写出C→D的化学方程式___________________________________________
(4)写出C+E→F的化学方程式_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A. 用CCl4提取溴水中的Br2
用CCl4提取溴水中的Br2
B. 除去乙醇中的四氯化碳
除去乙醇中的四氯化碳
C. 从KI和I2的固体混合物中回收I2
从KI和I2的固体混合物中回收I2
D. 配制100mL 0.1000molL-1的NaCl溶液
配制100mL 0.1000molL-1的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的结构式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成-1价阴离子为_________,该阴离子的电子总数是________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_______(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
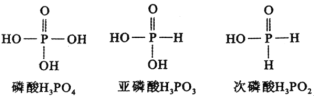
A.磷酸(![]() )的电离方程式为:
)的电离方程式为:![]()
B.亚磷酸(![]() )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成![]()
C.![]() 溶液呈酸性,是因为
溶液呈酸性,是因为![]() 的水解程度比电离程度大
的水解程度比电离程度大
D.![]() 溶液呈碱性
溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com