
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)+c(H+)=c(A-)+c(OH-) |


科目:高中化学 来源: 题型:
| A、Cl2为还原剂 |
| B、NH4Cl为氧化产物 |
| C、常温常压下有2.24LN2生成时转移0.6mol电子 |
| D、有2molNH3被氧化就有8molNH3参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、α1=α2=α3 |
| B、α1>α2>α3 |
| C、α1>α2=α3 |
| D、α1=α2<α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3和HCl、Na2CO3和HCl |
| B、BaCl2和H2SO4、Ba(OH)2和H2SO4 |
| C、HNO3和K2CO3、HCl和NaHCO3 |
| D、KOH和H2SO4、Ba(OH)2和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、吸热反应不加热就不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
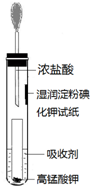 氯气是一种常用的自来水消毒剂.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是一种常用的自来水消毒剂.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com